Eksperimen Joule adalah percobaan yang dilakukan untuk mengukur keseteraan energi berdasarkan hukum kekekalan energi. Dalam percobaan Joule, Energi yang disetarakan adalah Energi Panas dan Energi Listrik.
Daftar isi
Eksperimen Joule
Bab I. Pendahuluan
A. Latar Belakang
Energi merupakan entitas yang siafatnya kekal. Sifat ini disebut sebagai kekekalan energi. Meskipun energi kekal, Bentuk energi tidak selalu sama dan selalu berubah. Karakteristik perubahan energi iniilah yang dimanfaat oleh manusia dalam kehidupan sehari-hari.
Contoh bentuk perubahan energi yang dimanfaatkan oleh antara lain (1) mengubah energi kimia menjadi menjadi energi gerak pada kendaraan, (2) mengubah energi listrik menjadi energi panas pada teko listrik, (3) mengubah energi suara menjadi gelombang kemudian kembali kebentuk suara pada telfon, dan masih banyak lagi. Jumlah energi yang berubah akan selalu sama sebelum dan setelah dirubah. Hanya saja bentuk dari energi yang dimanfaat masih sulit untuk mendapatkan efisiensi 100%. Efisiensi 100% berarti seluruh energi dari sumber diubah ke bentuk energi yang diinginkan. Faktanya tidak demikian.
Pada saat kita memanaskan air dengan listrik misalnya. Energi listrik tidak serta memanaskan air yang ada dalam teko saja, sebagian energi berubah menjadi energi yang tidak dibutuhkan misalnya menjadi energi suara, energi getar dan panas yang terbuang pada filamen.
Praktikum dengan judul eksperimen Joule ini bertujuan untuk mebghitung seberapa besar kesetaraan energi listrik dan energi panas yang dihasilkan dengan menggunakan kalorimeter.
B. Rumusan Masalah
- Seberapa besarkah efisiensi konversi energi panas kalorimeter?
Bab II. Kajian Teori
A. Hukum Kekekalan Energi
Hukum I. Termodinamika mengarahkan kita pada sebuah kesimpulan bahwa energi tidak dapat diciptakan dan tidak dapat dimusnakan. Energi hanya dapat berubah bentuk dari satu bentuk energi ke bentuk energi lain. Hukum ini juga menunjukkan bahwa setiap perubahan energi selalu melibatkan energi panas baik itu yang dapat dimanfaatkan dan terbuang sia-sia. Energi panas yang terbuang tidak mungkin bernilai nol, dengan demikian efisiensi mesin sangat mustahil mencapai angka 100%.
\Delta U= Q - W_s \ \ \ \ \ _{...(1)}Dimana :
ΔU : Perubahan energi Dalam (J)
Q : Energi Panas (J)
Ws : Kerja oleh Sistem (J)
Hukum Kekekalan energi ini tidak hanya berlaku pada fenomena termodinamika semata, namun berlaku untuk seluruh bentuk perubahan energi yang terjadi di dalam semesta. Mulai dari yang melibatkan energi panas, kekekalan energi mekanik sampai pada landasan teori pencipataan alam semesta yakni hubungan antara ruang, massa, energi positif dan energi gelap (Hawiking: 2002).
B. Kuantitas Energi Panas
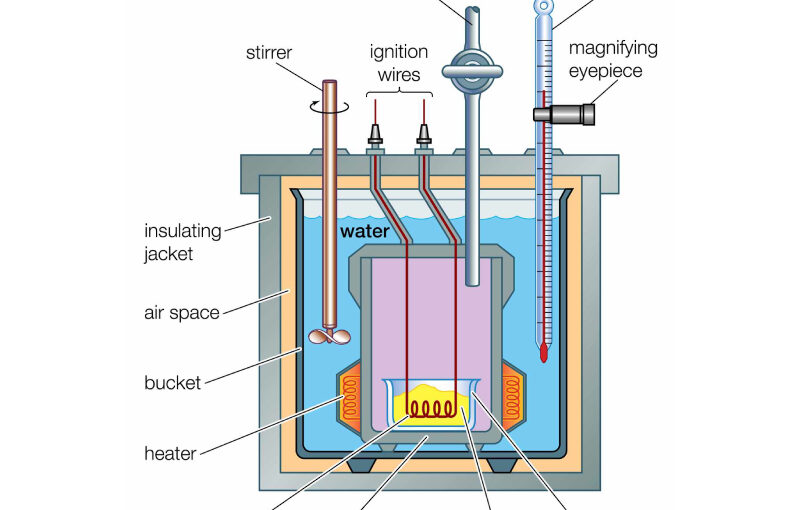
Pengukuran kuantitas energi panas pertama kali dilakukan oleh Joule (1840). Pengukuran ini dilakukan dengan nearuh sejumlah air dalam sebuah kalorimeter yang memiliki beberapa bilah di dalamnya. Bilah ini kemudian dihubungan dengan pemutar terikat pada sebuah beban. Ketika beban dilepaskan maka energi potensial dari beban berubah menjadi energi kinetik yang memutar stir di dalam kalori meter. Hal ini membuat suhu air di dalam kalorimeter naik. (AhmadDahlan.net)
Percobaan ini berhasil mendefenisikan 1 kalori yakni banyaknya energi panas yang dibutuhkan untuk menaikan suhu air sebanyak 1oC. 1 Kal ini setera dengan 4,180 J. Dimana Besar energi panas (Q) dapat ditulis
Q = m c \Delta T\ \ \ \ \ _{...(2)}C. Energi Listrik
Jika sebuah energi listrik dilarikan pada seutas kawat dengan hambatan R. Maka Hambatan kawat ini akan mengkonversi energi listrik menjadi energi panas. Besar energi panas yang dihasilkan oleh hambatan kawat setara dengan :
W = I^2Rt \ \ \ \ \ _{...(3)}Energi listrik berasal dari tegangan (V) diantara dua ujing kawat yang nilainya
V = I.R \ \ \ \ \ _{...(4)}Jika persamaan (4) ini disubtitusikan ke persamaan (3), maka persamana (3) dapat ditulis menjadi
W = VIt\ \ \ \ \ _{...(5)}Dimana
V : Ada beda potensial di ujung kawat (V)
I : Kuat arus (A)
t : Lama waktu aliran listrik (s)
Jika ujung kawat ini dicelupkan pada air dalam sebuah kalorimeter dengan asumsi tidak ada panas yang terbuang karena kalorimeter memiliki sistem termodinamika terisolasi, maka energi listrik ini akan menaikkan suhu air. Fenomena ini selanjutnya disebut konversi energi panas menjadi energi listrik.
W= Q \ \ \ \ \ _{...(6)}Jika persamaan (2) dan Persamaan (5) masukkan ke persamaan (6), maka didapatkan
VIt= mcΔT \ \ \ \ \ _{...(7)}Hanya saja sebagaimana yang disebutkan konsep awal dari konversi energi, dimana akan selalu ada pana yang terbuang, maka persamaan (7) dapat dikoreksi menjadi
VIt= ηmcΔT \ \ \ \ \ _{...(8)}Bab III. Metode Praktikum
A. Alat dan Bahan
- kalorimeter
- power supply
- basicmeter
- termometer celcius
- stopwatch
- neraca 311g
- kabel penghubung.
B. Prosedur Kerja
- Merangkai alat sesuai dengan skema percobaan
- Memastikan rangkaian yang telah disusun dengan benar.
- Memastikan bahwa polaritas dan batas ukur dari sumber dan alat-alat ukur arus dan tegangan benar.
- Mengukur massa massa kalorimeter kosong + pengaduk
- Mengisi kalorimeter dengan air hingga setengahnya lalu diukur kembali massanya.
- Memasang kalorimeter lengkap pada rangkaian, selanjutnya menyalakan catu daya
- Mengatur agar arus yang mengalir sebesar 2 A, selama proses berlangsung,
- Mencatat arus dan beda potensial pada ujung-ujung kumparan sesuai dengan percobaan.
- Mematikan kembali power supply dengan tidak mengubah posisi pengatur tegangan,
- Mengukur temperatur kalorimeter beserta isinya dan mencatat sebagai temperatur awal.
- Menyalakan kembali power supply bersamaan dengan menjalankan stop watch untuk mengukur lama pengaliran arus hingga temperatur sistem naik menjadi 10oC dari temperatur awal lalu menghentikan stop watch bersamaan dengan mematikan Power Supply, lalu mencatat penunjukan stopwatch berdasarkan percobaan.
- Mengulangi kegiatan ini hingga 3 (tiga) kali.
Bab IV. Hasil dan Pembahasan
A. Hasil Pengamatan
Percobaan I. Eksperimen Joule
NST Neraca Ohauss 311 g : 0,01g/skala
NST Voltmeter : 1 V/skala dan 0,5 v/skala
NST Amperemeter : 0,2 A/skala
NST Termometer : 1 skala
NST Stopwatch : 0,1 s/skala
Tabel :
| Besaran yang diukur | Pengukuran Ke – | |||
| I | II | III | ||
| Massa kalorimeter kosong + pengaduk, m1 (kg)) | 59,65 | │59,720 ± 0,005│ | │59,700 ± 0,005│ | |
| Massa kalorimeter + air, m2 (kg) | │219,300 ± 0,005│ | │212,500 ± 0,005│ | │199,600 ± 0,005│ | |
| Massa air, ma (kg) | │159,650 ± 0,010│ | │152,780 ± 0,010│ | │139,940 ± 0,010│ | |
| Tegangan, V (volt) | │11,0 ± 0,5│ | │11,0 ± 0,5│ | │11,0 ± 0,5│ | |
| Kuat Arus, I (A) | │1,854 ± 0,001│ | │1,858 ± 0,001│ | │1,877 ± 0,001│ | |
| Suhu awal, T0 (0C) | │34,0 ± 0,5│ | │34,0 ± 0,5│ | │34,0 ± 0,5│ | |
| Suhu akhir, Tf (0C) | │44,0 ± 0,5│ | │44,0 ± 0,5│ | │44,0 ± 0,5│ | |
| Waktu, t (s) | │330,0 ± 0,1│ | │310,0 ± 0,1│ | │301,0 ± 0,1│ | |
Analisis Data
Dalam praktikum ini Q lepas = Q terima
1. Energi panas yang diterima air dan kalorimeter
Q1 = m1.c1. 1 + mL.cL . 2
= 159.650 g . 1 kal/g . (44 – 34) + 59.650 g . 0,22 kal/g . (44-34)
= 159.650 g . 1 kal/g . 10 + 59650 g . 0,22 kal/g . 10
= 1596500 kal + 131230 kal
= 1727730 kal
Q2 = m2.c2. 1 + mL.cL. . 2
= 152780 g . 1 kal/g . (44 – 34) + 59720 g . 0,22 kal/g . (44 – 34)
= 1527800 kal + 131384 kal
= 1659184 kal
Q3 = m3.c3. 1 + mL.cL. . 2
= 139960. 1 kal/g . (44 – 34) + 59700 g . 0,22 kal/g . (44 – 34)
= 1399600 kal + 131340 kal
= 1530940 kal
2. Energi termal yang dilepaskan oleh elemen listrik
W1 = V1 . I1 . t1
= 11 v . 1,854 A . 330
= 6730,02 Joule
W2 = V2 . I2 . t2
= 11 v . 1,858 A . 310
= 6335,78 Joule
W3 = V3 . I3 . t3
= 11 v . 1,877 A . 301
= 6214,74 Joule
3. Ekivalensi kedua hasil
Q1 = W1
1727730 kal = 6730,02 Joule
Q2 = W2
1659184 kal = 6335,78 Joule
Q3 = W3
1530940 kal = 6214,74 Joule
4. Ketidakpastian setiap perhitumgan
1. Perhitungan 1
a. Energi lstrik (w)
Keterangan:
/skala
/skala
Penyelesaian:
W= V
670,33018 joule
Kr =
=
Dk = 100
= 100 – 9,9603 = 90,03976
Pf =
=
b. Keterangan :
Q air= m x c x ∆T
Q = | ∆T x ma| + |ma x ∆∆T|
= | 0,0000313 + 0,1 |6,7053
= | 0,1000313 |6,7053 kalori
= 0,670 kalori
DK = 100 % – KR = 100 % – 10,0025% = 89,9975 %
PF = | Qair± ∆Qair |
PF = | 6,705± 0,67 | kalori
c. Untuk Qkalorimeter
Keterangan:
Qk = mk x ck x ∆T
Q = | ∆T.mk | + |mk.∆∆T|
= | 0,0000838+ 0,1 | 25,265
= |0,1000838 |25,265 kalori
= 12,537 kalori
DK = 100 % – KR = 100 % – 10,0083% = 89,99 %
PF = |Qkalorimeter ± ∆Qkalorimeter |
PF = | 125 ± 12 | kalori
2. Perhitungan 2
∆W = | I x t x ∆V | + | V x t x ∆I | + | V x I x ∆t |
∆W = |0,0545745| 6335,78 joule
= 345,77203 joule
DK = 100 %- KR = 100 % – 0,054 57% = 99,94543%
PF = | W ± ∆W |
= | 6335 ± 345 | joule
a) Q = m x c x ∆T
Q = | ∆T.ma | + |ma.∆∆T|
= | 0,0000327+0,1| 6,41676
= 0,641 kalori
DK = 100 % – KR
= 100 % – 10,00327 %
= 89,996 %
PF = | Qair ± ∆Qair |
= |6,41676 ± 0,641 | kalori
b) Qk = mk x ck x ∆T
Q = | ∆T.mk | + |mk.∆∆T|
= |0,0000838+0,1| 6,41676
= 0,6422 kalori
DK = 100 % – KR
= 100 % – 10,008 %
= 89,992 %
PF = | Qkalorimeter± ∆Qkalorimeter |
= |6,41676 ± 0,6422 | kalori
3. Perhitungan 3
Keterangan:
=
= 0,5 Volt/skala
=
= 0,1 A/skala
a) W = V x I x t
∆W = | I.t. ∆V| + |V.t.∆I| + |V. I.∆t|
= | 0,578482| 6214,747 joule
= 3595,1192 joule
DK = 100 % – KR = 100 % – 0,5869% = 99,4131%
PF = | W ± ∆W |
= | 6124 ± 3595| joule
b) Q air= m x c x ∆T
Q = | ∆T.ma | + |ma.∆∆T|
= | 0,0000008 + 0,1|5,87748
= 0,5877527kalori
DK = 100 % – KR = 100 % – 10,00008% = 89,999 %
PF = | Qair ± ∆Qair |
= |5,87748 ± 0,5877527 | kalori
c) Untuk Q kalorimeter.
Qk = mk x ck x ∆T
Q = | ∆T.mk | + |mk.∆∆T|
= | 0,0000838+0,1|125,265
= 12,537 kalori
DK = 100 % – KR = 100 % – 10,008382 % = 89,99 %
PF = | Qkalorimeter ± ∆Qkalorimeter |
= |125,265 ±12,537 | kalori
B. Pembahasan
Kalorimeter merupakan suatu alat yang digunakan untuk mengukur jumlah kalor yang terlibat dalam suatu perubahan atau reaksi kimia. Hukum pertama termodinamika menghubungkan perubahan energi dalam suatu proses termodinamika dengan jumlah kerja yang dilakukan pada sistem dan jumlah kalor yang dipindahkan ke sistem.
Prinsip dari kerja kalorimeter adalah bila sebuah benda dengan suhu tertentu disinggungkan benda lain yang suhunya lebih rendah maka dalam selang waktu tertentu suhu kedua benda tersebut akan menjadi sama (setimbang). Hal ini terjadi karena benda yang bersuhu lebih tinggi memberikan panasnya ke benda yang bersuhu lebih rendah. Berdasarkan hukum kekekalan energi jumlah panas yang diberikan sama dengan jumlah panas yang diterima oleh benda yang bersuhu lebih rendah (Asas Black).
Dari hasil eksperimen ini, hasil pengukuran massa kalorimeter kosong adalah 59,65 kg, kalorimeter berisi air 219,3 kg dan air 159,65 kg dengan suhu awal 34 0C. Kemudian diberikan tegangan sebesar sebesar 11volt dan didapatkan nilai kuat arus sebesar 1,854 A Pada waktu 330 s, kemudian suhu akhir adalah 44 0C. Dari hasil perhitungan dengan persamaan W = VIt untuk mencari energi listrik didapatkan hasil 6730,02 joule. Sedangkan besar jumlah kalor yang diperlukan Q = mc(T-Ta) sebesar 1727730 kal.
Kemudian hasil pengukuran kedua yaitu dengan massa kalorimeter kosong yang sama, kalorimeter berisi air 212,5 kg dan air 152,78 kg dengan suhu awal 34 0C. Kemudian diberikan tegangan sebesar sebesar 11volt dan didapatkan nilai kuat arus sebesar 1,858 A Pada waktu 310 s, kemudian suhu akhir adalah 44 0C. Dari hasil perhitungan dengan persamaan W = VIt untuk mencari energi listrik didapatkan hasil 6335,78 joule. Sedangkan besar jumlah kalor yang diperlukan Q = mc(T-Ta) sebesar 1659184 kal.Dan pengukuran ketiga yaitu dengan massa kalorimeter kosong yang sama, kalorimeter berisi air 199,66 kg dan air 139,96 kg dengan suhu awal 34 0C. Kemudian diberikan tegangan sebesar sebesar 11volt dan didapatkan nilai kuat arus sebesar 1,877 A Pada waktu 301 s, kemudian suhu akhir adalah 44 0C. Dari hasil perhitungan dengan persamaan W = VIt untuk mencari energi listrik didapatkan hasil 6214,74 joule. Sedangkan besar jumlah kalor yang diperlukan Q = mc(T-Ta) sebesar 1530940 kal.
Melihat dari data hasil eksperimen ini, banyak yang harus di ubah dan jauh dari teori dimana angka ekivalensi seharusnya mendekati 0,24 Joule, namun dari perolehan hasil praktikum enersi listrik yang dilepas dan energy panas yang diterima menunjukkan angka yang terpaut jauh artinya terdapat sedikit kesalahan sehingga tidak menghasilkan angkamendekati 0,24. Hal ini dipengaruhi oleh banyak faktor antara lain suhu ruangan dipengaruhi AC yang akan mempengaruhi hasil ukur, karena membuat perubahan pada suhu awal maupun suhu akhir, kurang pekanya pengamat saat memencet tombol stopwatch yang akan menambah ataupun mengurangi waktu dan akhirnya akan mengubah hasil ukur, kondisi mata pengamat yang tidak normal dan berkaca mata serta kurang tepat dalam membaca data karena skala alat yang tertera sulit dibaca, adanya ketidaktepatan saat pembacaan skala pada thermometer, kemampuan kalorimeter dalam menyimpan panas yang tidak diketahui, yang menyebabkan tidak terdeteksinya kemungkinan panas yang lepas ke lingkungan, perbedaan antara hasil kesetaraan kalor listrik yang pertama dengan yang kedua disebabkan oleh peralatan yang digunakan pada percobaan kedua telah digunakan pada percobaan pertama. Sehingga peralatannya lebih peka merespon energi panas atau kalor yang ditransfer.
Sehubungan dengan masih banyaknya kesalahan dalam eksperimen ini, untuk itu dalam eksperimen selanjutnya mengenai eksperimen joule sebaiknya lebih teliti lagi dalam melihat dan mengamati, dan diharapkan lebih fokus dan lebih maksimal sehingga hasil yang diperoleh relevan dengan kesalahan yang kecil, sesuai dengan yang diharapkan.
Bab V. Penutup
A. Kesimpulan
Kesimpulan yang dapat ditarik melalui eksperimen ini adalah besarnya energi listrik yang dilepas oleh elemen listrik adalah pada percobaan pertama W1 = V1 . I1 . t1 adalah sebesar 6730,02 Joule kemudian percobaan kedua W2 = V2 . I2 . t2 sebesar 6335,78 Joule dan pada percobaan terakhir W3 = V3 . I3 . t3 sebesar 6214,74 Joule. Kemudian untuk besarnya energi panas/kalor yang diterima kalorimeter dan air adalah pada percobaan pertama Q1 = m1.c1. 1 + mL.cL. . 2 sebesar 1727730 kal kemudian percobaan kedua Q2 = m2.c2. 1 + mL.cL. . 2 sebesar 1659184 kal dan percobaan terakhir Q3 = m3.c3. 1 + mL.cL. . 2 sebesar 1530940 kal. Sehingga di hasilkan nilai kesetaraan kalor-listrik dalam percobaan ini adalah Q1 : W1, Q2 : W2 . Q3 : W3 sebesar .
Nilai kesetaraan jauh, dan tidak menghasilkan 0,24 sebagaimana teori. Hal tersebut disebabkan karena beberapa factor diantarnya kurang pekanya pengamat saat memencet tombol stopwatch yang akan menambah ataupun mengurangi waktu dan akhirnya akan mengubah hasil ukur, kondisi mata pengamat yang tidak normal dan berkaca mata serta kurang tepat dalam membaca data karena skala alat yang tertera sulit dibaca, adanya ketidaktepatan saat pembacaan skala pada thermometer, kemampuan kalorimeter dalam menyimpan panas yang tidak diketahui, sehingga tidak menjamin tidak adanya pengaruh lingkungan.
Daftar Pustaka
Hawking, Stephen. (2002). The Theory of Everything: The Origin and Fate of the Universe. London: New Millennium Press
· Halliday, David dan Resnick, Robert. 1999. Fisika Jilid 2 Edisi Kelima (Terjemahan). Jakarta: Erlangga.
· Tipler, Paul A. 2001. Fisika untuk Sains dan Teknik Edisi Kedua Jilid 2 (Terjemahan). Jakarta: Erlangga.
Leave a Reply
You must be logged in to post a comment.