Daftar isi
Senyawa Benzena
Bab I. Pendahuluan
A. Latar Belakang
Senyawa hidrokarbon merupakan senyawa karbon yang paling sederhana. Senyawa hidrokarbon merupakan senyawa yang hanya mengandung unsur karbon dan hidrogen (CxHy). Senyawa hidrokarbon dapat digolongkan berdasarkan struktur molekul dan kejenuhan ikatannya. Senyawa Hidrokarbon berdasarkan struktur molekulnya dibedakan atas tiga yaitu:
1. Senyawa Hidrokarbon Alifatik
Adalah senyawa hidrokarbon dengan struktur rantai karbon terbuka. Senyawa yang termasuk hidrokarbon alifatik adalah alkana(CnH2n+2),alkena(CnH2n),dan alkuna(CnH2n-2)
2. Senyawa hidrokarbon Alisiklik
Merupakan senyawa hidrokarbon yang memiliki struktur rantai karbon tertutup. Contohnya senyawa Hidrokarbon Alisiklik Siklopropana(C3H6) dan Siklobutana(C4H6).
3. Senyawa hidrokarbon Aromatis
Merupakan senyawa hidrokarbon yang memiliki rantai karbon tertutup dan mengandung dua atau lebih ikatan rangkap yang letaknnya berselang seling. Contoh dari senyawa ini adalah benzena dan toluena.
Penggolongan senyawa hidrokarbon berdasarkan Kejenuhan Ikatan yaitu :
1. Senyawa hidrokarbon Jenuh
ciri antaratom C berikatan tunggal(C-C).contohnya alkana dan golongan sikloalkana
2. Senyawa hidrokarbon tak jenuh
ciri antaratom C berikatan rangkap yaitu ikatan rangkap dua(C=C) atau ikatan rangkap tiga. Contohnya golongan alkena,golongan alkuna,dan golongan aromatik
Pada tahun 1825, benzena dan senyawa turunannya pertama kali disintesis oleh Michael Faraday, dari gas yang dipakai sebagai bahan bakar lampu penerang.Sepuluh tahun kemudian, diketahui bahwa benzena memiliki rumus molekul C6H6, sehingga disimpulkan bahwa benzena memiliki ikatan rangkap yang lebih banyak daripada alkena.Ikatan rangkap pada alkena dapat mengalami reaksi adisi, sedangkan ikatan rangkap pada benzena tidak dapat diadisi, tetapi benzena dapat bereaksi secara substitusi.
Senyawa aromatis adalah senyawa siklis yg memiliki sistem ikatan ganda dua terkonjugasi dengan jumlah elektron π= (4 n + 2). Senyawa tersebut merupakan senyawa hidrokarbon yang memiliki rantai karbon tertutup dan mengandung dua atau lebih ikatan rangkap yang letaknya bersealang seling.Salah satu senyawa aromatik yang dijumpai pada minyak bumi adalah senyawa fenol dan turunannya.Kadar fenol dan turunannya dalam limbah industri minyak dan gas bumi mengakibatkan tercemarnya lingkungan oleh senyawa beracun tersebut, serta memberikan ancaman terhadap lingkungan.
Menurut hukum Huckel untuk menjadi aromatis, suatu senyawa siklik dengan ikatan tunggal dan rangkap yang letaknya selang seling harus mengandung 4n+2= πe–, dimana n adalah bilangan bulat. Senyawa benzena merupakan senyawa-senyawa yang mempunyai bau (aroma) yang karakteristik, terutama yang berasal dari tumbuh-tumbuhan, misalnya alkaloida, flavonoida, kumarin, anilin dan lain-lain.
Pada tahun 1872, menurut Friedrich August Kekule, keenam atom karbon pada benzena tersusun secara siklik membentuk segienam beraturan dengan sudut ikatan masing-masing 120°.Ikatan antaratom karbon adalah ikatan rangkap dua dan tunggal bergantian (terkonjugasi). Kekule menemukan struktur benzena yang semua ikatan C-C dalam benzena panjangnya sama, baik ikatan tunggal maupun ikatan rangkap dan mempunyai panjang ikatan 1,40 Ao.
Senyawa ini cukup distabilkan oleh delokalisasi elektron-pi.Energi resonansi suatu senyawa aromatik merupakan uluran diperolehnya kestabilan. Adanya delokalisasi elektron akan menstabilkan struktur, maka cincin benzena lebih stabil (energi rendah) dari pada hipotesa suatu trienasiklik. Energi stabilitas senyawa aromatik disebut energi resonansi, untuk benzena besarnya 36 kcal/mol. Energi resonansi untuk senyawa aromatik dapat ditentukan secara percobaan.
Manfaat senyawa aromatic begitu banyak diaplikasikan dikehidupan sehari hari begitu juga dampak yang diberikan oleh senyawa aromatis ini,oleh sebab itu penulis ingin menjelaskan secara terperinci tentang senyawa aromatis .
B. Rumusan Masalah
- Apa yang dimaksud dengan senyawa benzena ?
- Apakah senyawa aromatik ?
- Apa saja yang termasuk senyawa aromatik dan bagaimana strukurnya?
- Apa yang dimaksud dengan senyawa aromatik heterosiklik?
- Apa saja syarat senyawa aromatik?
- Apa saja turunan benzena?
- Bagaimana penamaan senyawa benzena?
- Bagaimana kesetabilan benzena?
- Apa sifat fisika dan kimia senyawa aromatik?
- Cara pembuatan benzena?
- Apa kegunaan senyawa benzena dan dampaknya
C. Tujuan
Tujuan dalam penulisan makalah ini, antara lain:
- Menjelaskan dan mendeskripsikan tentang senyawa aromatik dan turunannya.
- Menerangkan cara penamaan dan reaksi pembuatan senyawa aromatik.
- Mengetahui perbedaan senyawa aromatik dan non aromatik.
- Menjelaskan kegunaan dan dampak dari penggunaan senyawa aromatik dalam kehidupan.
- Menerangkan reaksi reaksi pembuatan senyawa aromatis.
- Menjelaskan bagaimana aplikasi senyawa aromatis dalam berbagai industri dan memberikan informasi terbaru dari senyawa aromatis tersebut.
Bab II. Pembahasan
A. Definisi
Senyawa benzena mempunyai rumus molekul C6H6, dan termasuk dalam golongan senyawa hidrokarbon aromatik. Nama aromatik digunakan karena senyawa tersebut berbau harum.dari rumus molekulnya dapat diketahui bahwa benzena merupakan senyawa tidak jenuh karena tidak memenuhi rumus CnH2n+2.Bila dibandingkan dengan senyawa hidrokarbon lain yang mengandung 6 buah atom karbon, misalnya heksana (C6H14) dan sikloheksana (C6H12), maka dapat diduga bahwa benzena mempunyai derajat ketidakjenuhan yang tinggi. Dengan dasar dugaan tersebut maka dapat diperkirakan bahwa benzena memiliki ciri-ciri khas seperti yang dimiliki oleh alkena.Perkiraan tersebut ternyata jauh berbeda dengan kenyataannya, karena benzena tidak dapat bereaksi seperti alkena (adisi, oksidasi, dan reduksi).Lebih khusus lagi benzena tidak dapat bereaksi dengan HBr, dan pereaksi-pereaksi lain yang lazimnya dapat bereaksi dengan alkena.Sifat-sifat kimia yang diperlihatkan oleh benzena memberi petunjuk bahwa senyawa tersebut memang tidak segolongan dengan alkena ataupun sikloalkena.
Senyawa benzena dan sejumlah turunannya digolongkan dalam senyawa aromatik, Penggolongan ini dahulu semata-mata dilandasi oleh aroma yang dimiliki sebagian dari senyawa-senyawa tersebut. Perkembangan kimia pada tahap berikutnya menyadarkan para kimiawan bahwa klasifikasi senyawa kimia haruslah berdasarkan struktur dan kereaktifannya, dan bukan atas dasar sifat fisikanya.Saat ini istilah aromatik masih dipertahankan, tetapi mengacu pada fakta bahwa semua senyawa aromatik derajat ketidakjenuhannya tinggi dan stabil bila berhadapan dengan pereaksi yang menyerang ikatan pi (π).
Istilah senyawa aromatikpada awalnya digunakan untuk menerangkan senyawapemberi aroma seperti benzaldehid (dari buahcherries, peaches, dan almonds), toluena (dari balsam Tolu), dan benzena (dari distilat batubara). Adapun contoh struktur molekul senyawa aromatis dapat dilihat pada Gambar 2.1.
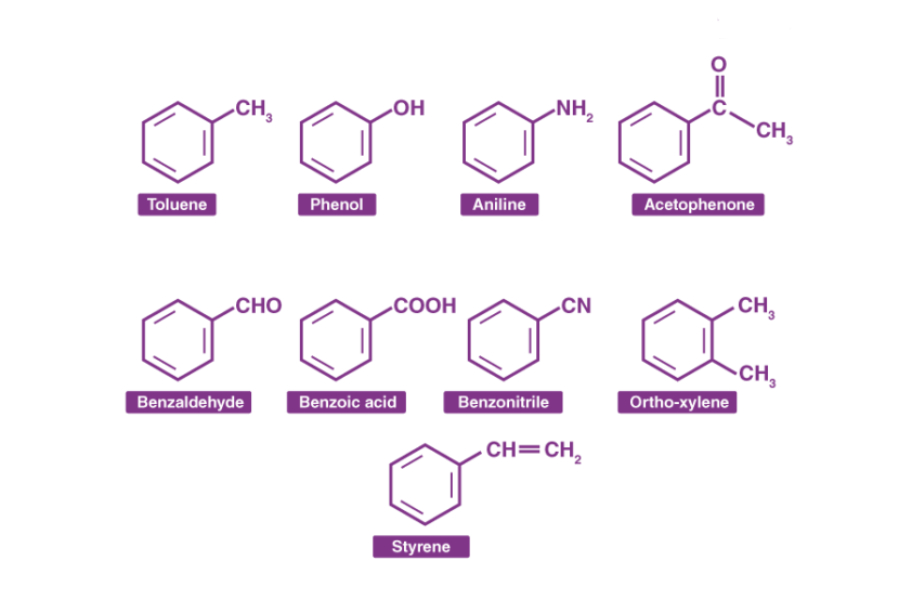
Gambar 2.1 Contoh senyawa aromatis
B. Senyawa Aromatis dan Strukturnya
Namun sekarang istilah senyawa aromatic digunakan untuk merujuk kelassenyawa yang mengandung enam karbon seperticincin benzena dengan tiga ikatan rangkap dua. Adapun yang termasuk senyawa aromatis yaitu:
- senyawa benzena
- senyawa dengan sifat kimia seperti sbenzena.
Para kimiawan membagi semua senyawa organik ke dalam dua kelas yang lebih luas, yaitu senyawa alifatik dan senyawa aromatik. Berasal dari kata alifatis berarti bersifat lemak dan aromatik berarti harum. Senyawa alifatik adalah senyawa rantai terbuka atau senyawa siklik yang sifat kimianya mirip dengan senyawa rantai terbuka, sedangkan senyawa aromatik adalah benzena atau senyawa yang sifat kimianya menyerupai benzena.
Suatu senyawa aromatik memiliki orbital terdelokalisasi (delokal) yang berbentuk cincin. Banyaknya elektron p yang terlibat dalam orbital delokal dapat ditentukan dengan rumus Huckel:
Elektron p = 4 n+ 2
Dengan n = 0, 1, 2, 3,……….
I. Ikatan Dalam Aromatis
Dalam tahun 1825 Ahli Kimia Inggris Michael Faraday mengisolasi suatu cairan berminyak dari saluran gas London. Senyawa ini ternyata mempunyai rumus molekul C2H6 dan diberi nama Benzena. 40 Tahun kemudian ahli Kimia Jerman, Friederich August Kekule menemukan struktur ini. Hampir 75 tahun kemudian baru dibentuk struktur benzen yang modern.
Persoalan pertama dalam membuat struktur benzen yang dapat diterapkan berdasarkan fakta bahwa struktur yang adekuat tak dapat digambarkan apabila memakai garis ikatan yang biasa. Sekarang kiat emngetahui bahwa enam karbon atau benzen adalah sp2yang hibrid dan disusun dalam bentuk cincin dengan 6 anggota. Tiap atom karbon mengandung sebauah elektron dalam orbit p. Kita harapkan bahwa enam elektron p ini ada dalam tiga ikatan.
Tetapi rumus bangun ini tidak menerangkan mengapa benzene tak mengalami reaksi seperti alkena.Lagi pula semua ikatan C-C dalam benzen panjangnya sama, tak mengandung tiga ikatan rangkap yang pendek dan tiga ikatan tunggal yang panjang.
Semua ikatan C-C mempunyai panjang iaktan 1,40A, ikatan antara ikatan tunggal C-C (1,54 A) dan antara ikatan rangkap C=C (1,34A).
Gambar 2.2 Struktur Rantai Benzena Gambar 2.3 Ikatan dalam Aromatis
Semua atom C dalam senyawa-senyawa di atas mempunyai hibrida sp2 dan terletak dalam satu bidang dengan orbital p yang tegak lurus pada bidang. Sejalan dengan konsep ikatan delokalisasi maka benzena mempunyai orbital terdelokalisasi yang berbentuk cincin, dan elektron p sebanyak 6 (mengikuti hokum Huckel dengan n = 1). Dalam naftalena, jumlah electron p-nya adalah 10. Hal ini mengikuti hokum Huckel dengan n = 2. Contoh senyawa aromatik adalah benzena dan naftalena. Adapun rumus strukturnya dapat dilihat pada Gambar 2.4.
Gambar 2.4Struktur Lewis Benzena dan Naftalena
Benzena merupakan termasuk dari golongan senyawa aromatis yang paling sederhana. Benzena mempunyai rumus (C6H6) di mana merupakan dari hidrokarbon tidak jenuh sehingga mudah bereaksi dengan senyawa atau unsur lain membentuk senyawa baru. Rumus molekul benzena telah ditemukan sejak tahun 1834 yaitu C6H6. Rumus molekul ini memperlihatkan ketidakjenuhan karena tidak memenuhi rumus CnH2n+2. Akan tetapi benzena tidak memperlihatkan ketidakjenuhan, benzena tidak melunturkan warna air bromin (tidak diadisi oleh bromin). Hasil percobaan menunjukkan bahwa monosubstitusi benzena, C6H5X, tidak mempunyai isomer. Hal ini mengisyaratkan bahwa keenam atom H pada benzena mempunyai kedudukan yang ekivalen.
Sementara itu, disubstitusi benzena, C6H4X2, mempunyai tiga isomer. Rumus struktur benzena menjadi persoalan bertahun-tahun yang kemudian terselesaikan atas usul Kekule tahun 1865 yang mengusulkan agar enam atom hidrogen yang terikat pada atom-atom karbon pada molekul C6H6 dibuat setara. Menurut Kekule, struktur yang paling mungkin dari C6H6 adalah struktur cincin yaitu struktur lingkar enam dengan tiga ikatan rangkap yang berkonjugasi dan berpindah-pindah ( beresonansi ) sebagai struktur benzena yang beresonansi dapat dilihat pada Gambar 2.5
Gambar 2.5Struktur Benzena yang Beresonansi
Ikatan rangkap dalam benzena selalu berpindah-pindah, maka semua ikatan karbon-karbonnya sama panjang, yaitu antara ikatan tunggal dan ikatan rangkap. Dari percobaan diketahui panjang ikatan C – C dalam benzena adalah 140 pm. Dilihat dari struktur resonansi benzena, ikatan tunggal dan ikatan rangkap antara dua atom C bergerak dinamis ( berputar ) berganti-ganti. Jadi, struktur molekul benzena seperti Gambar 2.6.
Gambar 2.6Struktur Benzen
Rumus Kekule juga dapat menjelaskan tiga jenis isomer benzena disubstitusi, C6H4X2. Ketiga isomer itu ditandai dengan ortho ( o ), meta ( m ), dan para ( p ). Adapun struktur posisi orto, para, dan meta seperti Gambar 2.7
Gambar 2.7 Posisi Orto, Para dan Meta
Dari pembehasan tentang teori atom, telah kita ketahui bahwa elektron dalam atom berada dalam orbital atom. Orbital tersebut ada yang berbentuk bola (orbital s), balon terpilin (orbital p) atau bentk baling-baling (orbital d). dalam molekul, elektron juga berada dalam orbital yaitu dalam orbital molekul (OM). Menurut teori ikatan valensi, orbital molekul terbentuk dari pertumpangtindihan orbital-orbital atom. Pertumpangtindihan orbital-orbital atom dapat terjadi menurut dua cara seperti terlihat pada Gambar 2.8 Sedangkan pembentukan ikatan phi terlihat pada Gambar 2.9
Gambar 2.8 Pertumpangtindihan Orbital-orbital
Keterangan :
1. Pertumpangtindihan ujung dengan ujung (head to head overlap). Ikatan kovalen yang terbentuk dengan pertumpangtindihan jenis ini disebut ikatan sigma (σ).
2. Pertumpangtindihan sisi dengan sisi (side to side overlap). Ikatan kovalen yang terbentuk dengan pertumpangtindihan sisi dengan sisi disebut ikatan phi (π).
Gambar 2.9Pembentukan Ikatan Phi
Salah satu syarat bagi pembentukan ikatan Phi adalah kedua orbital yang bertumpang tindih harus sebidang, ikatan pertama yang terjadi antara dua atom selalu berupa ikatan sigma, sedangkan ikatan kedua dan ketiga adalah ikatan phi.
Pada pembentukan senyawa aromatis, atom karbon dapat mengalami tiga macam hibridisasi, yaitu sp, sp2, dan sp3. Hibridisasi sp3menghasilkan empat orbital hibrida yang mempunyai susunan tetrahedral. Hibridisasi sp2menghasilkan tiga orbital hibrida yang mempunyai susunan segitiga sama sisi dan satu orbital p yang tegak lurus pada bidang segitiga tersebut. Hibridisasi sp menghasilkan dua orbital hibrida yang terbentuk linear dan dua orbital p yang tegak lurus satu sama lain, juga tegak lurus terhadap orbital hibrida sp tersebut.
Tipe hibridisasi pada suatu atom pusat tergantung pada jumlah domain elektron pada kulit luar atom pusat itu. Untuk senyawa karbon, jumlah domain elektron sama dengan jumlah ikatan sigma yang dibentuk. Setiap ikatan sigma memerlukan satu orbital hibrida. Sesuai dengan struktur Kekule, setiap atom karbon dalam benzena membentuk 3 ikatan sigma dan 1 ikatan phi. Jadi atom karbon dalam benzena mengalami hibridisasi sp2. Peta konsep terlihat pada Gambar 2.10
Pembentukan cincin benzena dapat digambarkan sebagai berikut: setiap atom karbon menggunakan dua orbital hibrida sp2untuk membentuk ikatan dengan sesama atom karbon, sedangkan satu orbital sp2digunakan untuk mengikat atom hidrogen. Keberadaan elektron-elektron yang terdelokalisasi seputar lingkaran menjadi cirri dari senyawa aromatik. Hal itu pula yang menyebabkan mengapa benzena sangat stabil dan sukar mengalami adisi. Untuk mempermudah penulisan, rumus bangun benzena dapat digambarkan berupa segienam beraturan dengan lingkaran di tengahnya. Lingkaran itu menggambarkan elektron-elektron p yang mengalami delokalisasi.
Gambar 2.10 Peta konsep
2.1.3 Aromatisasi Dan Aturan HUCKEL
Struktur benzena dan turunannya seperti disebutkan diatas memperlihatkan adanya 6 elektron π dalam sistem siklik terkonjugasi. Siklobutadiena dan siklooktatetraena juga memiliki cincin siklik dengan ikatan rangkap dua terkonjugasi
siklobutadiena siklooktatetraena
Gambar 2.11 Siklobutadiena dan Siklooktatetraena
Sekarang timbul pertanyaan yaitu apakah kedua senyawa tersebut termasuk senyawa aromatik?
Ternyata keduanya tidak memiliki sifat aromatik walaupun terdapat ikatan terdelokalisasi pada cincinnya. Menurut Huckel, senyawa aromatik adalah senyawa yang memiliki sistem ikatan rangkap dua terkonjugasi dengan jumlah elektron π = (4n + 2), dengan n adalah bilangan bulat 0, 1, 2, 3 … jadi senyawa siklik dengan ikatan rangkap dua terkonjugasi memiliki jumlah elektron π = 2, 6, 10, 14 …. Adalah aromatik. Sedangkan siklobutadiena dan siklooktatetraena dengan 4 dan 8 elektron π, tidak memenuhi rumusan 4n + 2 sehingga bukan senyawa aromatik.
a. Ion-Ion Aromatik
Mencermati definisi Huckel di atas terlihat bahwa batasan tersebut tidak mempersyaratkan bahwa banyaknya orbital p harus sama dengan jumlah elektron π. Kenyataannya kedua hal ini dapat saja berbeda. Rumusan Huckel berlaku luas terhadap berbagai jenis spesies kimia, bukan hanya terhadap hidrokarbon netral.
Contoh:
anion siklopentadienil kation sikloheptatrienil
Kedua spesies ini adalah aromatik
Gambar 2.12 Anion dan Kation Senyawa Aromatik
Molekul netral siklopentadiena sendiri tidak bersifat aromatis karena molekulnya tidak terkonjugasi penuh. Karbon gugus –CH2- dalam cincin adalah hibrida sp3, jadi menghalangi konjugasi –siklis orbital p. Akan tetapi bila satu atom H dari gugus –CH2- lepas maka karbon sp3 berubah menjadi sp2 sehingga spesies sekarang mengandung 5 orbital p. Ada 3 cara pelepasan hidrogen dari gugus –CH2-, yaitu atom H pergi dengan membawa satu elektron, atom H pergi tanpa electron, dan atom H membentuk radikal.
Gambar 2.13 Kation, Radikal dan Anion Senyawa Benzena
Teori resonasi meramalkan ketiga spesies di atas sangat stabil sebab masing-masing mempunyai 5 struktur resonasi yang ekuivalen. Sedangkan teori Huckel meramalkan bahwa hanya anion yang dengan 6 elektron p adalah aromatik. Kenyataannya kation dan radikal siklopentadienil sulit dibuat, sedangkan karbanionnya dengan mudah dibuat dan karbanion ini sangat stabil. Fakta lain yang mendukung adalah bahwa siklopentadiena adalah hidrokarbon yang paling asam di antara hidrokarbon yang lain, pKa dari kebanyakan hidrokarbon 45, sedangkan siklopentadiena mempunyai pka = 16, harga yang sebanding denganpKa air.
Siklopentadiena bersifat asam oleh karena anion yang terbentuk oleh ionisasi adalah cukup stabil. Tidak peduli bahwa anion siklopentadienil hanya mempunyai 5 orbital p.
Dengan alas an yang serupa dapat digunakan untuk meramalkan kestabilan kation, radikal dan anion sikloheptatrienil. Menurut teori resonansi ketiga spesies ini mempunyai kestabilan yang tinggi, akan tetapi menurut Huckel hanya kation sikloheptatrienil yang mempunyai kestabilan aromatik.
b. Pandangan Teori Resonansi
Pada mulanya struktur benzena dinyatakan oleh Kekule seperti berikut:
Gambar 2.14 Struktur Kekule
Akan tetapi karena panjang ikatan dalam molekul benzena semuanya sama, yaitu 1,39 A, dan benzena adalah senyawa tunggal (tidak mempunyai isomer); maka ikatan delokal dalam sistem benzena ditulis dengan struktur resonansi sebagai berikut:
Banyaknya ikatan p dan s adalah sama, karena itu dikatakan kedua struktur ekivalen dalam energi dan merupakan struktur resonansi yang penting. Masih ada struktur resonansi benzena yang lain, namun struktur resonansi tersebut tidak penting karena kandungan energinya tinggi. Misalnya yang dituliskan sebagai berikut:
Gambar 2.15 Resonansi pada Benzena
Gambar 2.16 Resonansi Benzena
Semakin banyak struktur resonansi yang dibuat untuk suatu senyawa, semakin besar pula energi resonansinya dan semakin stabil senyawa tersebut.
2.1.4 Benzena
Benzena dan Turunannya Senyawa benzena pertama kali disintesis oleh Michael Faraday pada tahun 1825, dari gas yang dipakai sebagai bahan bakar lampu penerang.Sepuluh tahun kemudian diketahui bahwa benzena memiliki rumus molekul C6H6 sehingga disimpulkan bahwa benzena memiliki ikatan rangkap yang lebih banyak daripada alkena.
Dari residu berminyak yang tertimbun dalam pipa induk gas di London. Saat ini sumber utama benzena, benzena tersubtitusi dan senyawa aromatic adalah petroleum : sebelumnya dari ter batubara hamper 90% senyawa aktif bahan obat adalah senyawa aromatik : rumus struktur mempunyai inti benzena.
Energi Resonansi Pada Benzena
Untuk menghitung tentang apa yang dimaksud dengan energi resonansi, maka simaklah data panas hidrogenasi beberapa senyawa sebagai berikut
Gambar 2.17 Kalor pada Beberapa Benzena
Dari persamaan (4.1) terlihat bahwa untuk hidrogenasi satu ikatan rangkap dua dilepaskan kalor sebesar 28,6 kkal/mol. Sedangkan persamaan (4.2) menunjukkan bahwa hidrogenasi dua buah ikatan rangkap dua dilepaskan kalor sebesar 55,4 kkal/mol. Harga ini kira-kira sama dengan 2 x 28,6 kkal/mol. Dengan demikian dapat diharapkan bahwa
hidrogenasi tiga buah ikatan rangkap dua seperti struktur resonansi benzena akan melepaskan kalor sebesar 3 x 28,6 = 86 kkal/mol. Sedangkan dari persamaan (6.3) terlihat bahwa panas hidrogenasi molekul benzena yang sesungguhnya adalah 49,8 kkal/mol. Untuk lebih jelasnya harga-harga tersebut disajikan dalam diagram berikut:
Gambar 2.18 Diagram Panas Hidrogenasi Benzena
Dari diagram di atas terlihat bahwa molekul benzena yang sesungguhnya memiliki energi lebih rendah dari pada struktur resonansi yang dibuat. Hal ini berarti bahwa struktur benzena yang sesungguhnya adalah lebih stabil disbanding struktur resonansinya yang paling stabil. Pada diagram juga tampak bahwa antara struktur benzena sesungguhnya dengan struktur resonansi terdapat selisih energi sebesar 36 kkal/mol. Harga selisih energi ini dinamakan energi kestabilan atau energi resonansi. Jadi energi resonansi adalah perbedaan energi antara struktur sesungguhnya dengan struktur resonansi yang paling stabil. Semakin besar energi resonansi, maka senyawa bersangkutan semakin stabil.
2.1.5 Isomer Benzena (C6H6)
Struktur benzena yang lebih tepat memang telah ditentukan akan tetapi rumus kimia C6H6 memberikan kemungkinan lain untuk senyawa kimia. Senyawa – senyawa lain yang memiliki rumus C6H6 ini kita kenal sebagai isomer benzena. Sebelum membahas lebih jauh tentang berbagai kemungkinan struktur isomer-isomer benzena, perlu diperhatikan bahwa benzena terdiri dari enam atom karbon dengan satu atom hidrogen yang menempel pada atom karbonnya. Dengan kata lain, benzena terdiri atas enam gugus CH. Oleh karena itu isomer benzena yang memiliki enam gugus CH disebut isomer valensi (Gutman & Potgieter, 1994: 222).
Gutman & Potgieter (1994: 222) menjelaskan bahwa hidrokarbon yang memiliki rumus molekul CnHm akan memiliki r = (2n + 2 – m)/2 cincin dan atau ikatan rangkap. Hal ini berarti spesi C6H6 dapat berupa:
a. Empat cincin tanpa ikatan rangkap
b. Tiga cincin dan satu ikatan rangkap dua
c. Dua cincin dengan dua ikatan rangkap dua
d. Dua cincin dengan satu ikatan rangkap tiga
e. Satu cincin dengan tiga ikatan rangkap dua
2.1.6 Persyaratan Senyawa Aromatik
Tidak semua senyawa yang memiliki ikatan rangkap yang berselangseling dengan ikatan tunggal (memiliki ikatan rangkap terkonjugasi) dapat digolongkan sebagai senyawa aromatis dan yang termasuk senyawa aromatis syaratnya adalah:
1. molekul harus siklik dan datar.
2. memiliki orbital p yang tegak lurus pada bidang cincin (memungkinkan terjadinya delokalisasi elektron pi) bila tidak , tidak mungkin terjadi delakolasi penuh electron Phi.
3. Memiliki elektron pi = 4n + 2 (aturan Huckle) n = bilangan bulat.
Gambar 2.19 Struktur Siklooktatraena
siklooktatetraena tidak aromatik 8 elektron pi.
2.2 Sifat-sifat senyawa aromatis
2.2.1 Sifat Fisik
· Zat cair tidak berwarna
· Memiliki bau yang khas
· Mudah menguap
· Benzena digunakan sebagai pelarut.
· Tidak larut dalam pelarut polar seperti air air, tetapi larut dalam pelarut yang kurang polar atau nonpolar, seperti eter dan tetraklorometana
· Larut dalam berbagai pelarut organik.
· Benzena dapat membentuk campuran azeotrop dengan air.
· Densitas : 0,88
· Senyawanya berupa senyawa lingkar/siklis.
· Terjadi resonansi (pergerakan elektron di dalam molekul).
· Terjadi delokalisasi elektron pada struktur benzena.
· Mempunyai aroma yang khas.
2.1Titik Didih Dan Titik Leleh Beberapa Senyawa Aromatis
| TL | TD | |
| BENZENA | 5,5 | 80 |
| TOLUNA | -95 | 111 |
| o-XILENA | -25 | 144 |
| m-XILENA | -48 | 139 |
| p-XILENA | 13 | 138 |
2.2.2 Sifat Kimia
· Bersifat bersifat toksik-karsinogenik (hati-hati menggunakan benzena sebagai pelarut, hanya gunakan apabila tidak ada alternatif lain misalnya toluena)
· Merupakan senyawa nonpolar
· Tidak begitu reaktif, tapi mudah terbakar dengan menghasilkan banyak jelaga
· Lebih mudah mengalami reaksi substitusi dari pada adisi.
· walaupun sukar diadisi tapi benzena masih dapat diadisi dengan katalis yang tepat, misalnya:
1. Adisi dengan hidrogen dengan katalis Ni/Pt halus.
2. Adisi dengan CL2 atau BR2 dibawah sinar matahari.
· Sukar dioksidasi dengan senyawa oksidator seperti KMnO4, K2Cr2O7, dll.
· Reaksi pada benzena harus menggunakan katalis karena kestabilan molekul benzena.
2.2.3 Sifat Fisika dan Kimia Benzena
Menurut The Chemical Abstract Service (CAS) benzena mempunyai nomor 71-43-42. Benzene merupakan senyawa hidrokarbon aromatik rantai tertutup tidak jenuh, mempunyai nama lain benzol, cyclohexatrene, phenylhydride, atau coal naphta.
Struktur Benzena
Ikatan rangkap pada benzena berbeda dengan ikatan rangkap pada alkena. Ikatan rangkap pada alkena dapat mengalami reaksi adisi, sedangkan ikatan rangkap pada benzena tidak dapat diadisi, tetapi benzena dapat bereaksi secara substitusi. Contoh:
Reaksi adisi : C2H4 + Cl2 –> C2H4Cl2
Reaksi substitusi : C6H6 + Cl2 –> C6H5Cl + HCl
Menurut Friedrich August Kekule, keenam atom karbon pada benzena tersusun secara siklik membentuk segienam beraturan dengan sudut ikatan masing-masing 120°. Ikatan antaratom karbon adalah ikatan rangkap dua dan tunggal bergantian (terkonjugasi).
Gambar 2.20. Struktur Antar Atom Benzena
Analisis sinar-X terhadap struktur benzena menunjukkan bahwa panjang ikatan antaratom karbon dalam benzena sama, yaitu 0,139 nm. Adapun panjang ikatan rangkap dua C=C adalah 0,134 nm dan panjang ikatan tunggal C–C adalah 0,154 nm. Jadi, ikatan karbon-karbon pada molekul benzena berada di antara ikatan rangkap dua dan ikatan tunggal. Hal ini menggugurkan struktur dari Kekule.
Kekulé menggambarkan struktur benzena dengan atom-atom karbon dihubungkan satu dengan yang lain membentuk suatu cincin.
Gambar 2.21 Struktur Benzena Menurut Kekule
August Kekulé pada tahun 1865 : Struktur tersebut menggambarkan bahwa struktur benzena tersusun 3 ikatan rangkap di dalam cincin 6 anggota.
• Ketiga ikatan rangkap tersebut dapat bergeser dan kembali dengan cepat sedemikian sehingga 2 bentuk yang mungkin tersebut tidak dapat dipisahkan.
Gambar 2.22 Resonansi Benzena
Orbital benzena
Gambar 2.23. Orbital Benzena
Setiap karbon pada benzena mengikat 3 atom lain menggunakan orbital hibridisasisp2 membentuk molekul yang planar. Benzena merupakan molekul simetris, berbentuk heksagonal dengan sudut ikatan 120o.
— Setiap atom C mempunyai orbital ke empat yaitu orbital p. Orbital pakan
— mengalamitumpang siuh (overlapping) membentuk awan elektron sebagai sumber elektron.
2.2.4 Senyawa Aromatik Heterosiklik
Menurut Erich Huckel, suatu senyawa yang mengandung cincin beranggota lima atau enam bersifat aromatik jika:
· semua atom penyusunnya terletak dalam bidang datar (planar)
· setiap atom yang membentuk cincin memiliki satu orbital 2p
· memiliki elektron pi dalam susunan siklik dari orbital-orbital 2p sebanyak 4n+2 (n= 0, 1, 2, 3, …)
Di samping benzena dan turunannya, ada beberapa jenis senyawa lain yang menunjukkan sifat aromatik, yaitu mempunyai ketidakjenuhan tinggi dan tidak menunjukkan reaksi-reaksi seperti alkena. Senyawa benzena termasuk dalam golongan senyawa Homosiklik, yaitu senyawa yang memiliki hanya satu jenis atom dalam sistem cincinnya.
Gambar 2.24. Struktur Piridina dan Pirimidina
Terdapat senyawa heterosiklik, yaitu senyawa yang memiliki lebih dari satu jenis atom dalam sistem cincinnya, yaitu cincin yang tersusun dari satu atau lebih atom yang bukan atom karbon.Sebagai contoh, piridina dan pirimidina adalah senyawa aromatik seperti benzena.Dalam piridina satu unit CH dari benzena digantikan oleh atom nitrogen yang terhibridisasi sp2, dan dalam pirimidina dua unit CH digantikan oleh atom-atom nitrogen yang terhibridisasi sp2.
Senyawa-senyawa heterosiklik beranggota lima seperti furan, tiofena, pirol, dan imidazol juga termasuk senyawa aromatik.
2.3 Senyawa Turunan Benzena
Kemudahan benzena mengalami reaksi substitusi elektrofilik menyebabkan benzena memiliki banyak senyawa turunan.Semua senyawa karbon yang mengandung cincin benzena digolongkan sebagai turunan benzena. Berikut ini beberapa turunan benzena yang umum:
Tabel 2.2 Struktur Turunan Benzena
| Struktur | Nama |
| Toluena | |
| p-xilena | |
| Stirena | |
| Anilina | |
| Fenol | |
| Benzaldehid | |
| Asam Benzoat | |
| Benzil Alkohol |
Selain senyawa-senyawa di atas, masih banyak lagi senyawa turunan benzena yang terdapat di sekitar kita baik itu dengan satu substituen yang terikat pada cincin benzena, ataupun dua substituen atau lebih.
2.4 Tata Nama Senyawa Benzena
2.4.1 IUPAC
Semua senyawa yang mengandung cincin benzena digolongkan sebagai senyawa turunan benzena. Penataan nama senyawa turunan benzena sama seperti pada senyawa alifatik, ada tata nama umum (trivial) dan tata nama menurut IUPAC yang didasarkan pada sistem penomoran. Dengan tata nama IUPAC, atom karbon dalam cincin yang mengikat substituen diberi nomor terkecil. Menurut IUPAC, benzena dengan satu substituen diberi nama seperti pada senyawa alifatik, sebagai gugus induknya adalah benzena.
Contoh:
Gambar 2.25 Hidroksibenzena, Aminobenzena dan Nitrobenzena
Benzena dengan gugus alkil sebagai substituen, diklasifikasikan sebagai golongan arena. Penataan nama arena dibagi ke dalam dua golongan berdasarkan panjang rantai alkil. Jika gugus alkil berukuran kecil (atom C6) maka gugus alkil diambil sebagai substituen dan benzena sebagai induknya. Contoh:
Gambar 2.26 Butilbenzena dan Isopropilbenzena
Jika gugus alkil berukuran besar (atom C 6) maka benzena dinyatakan sebagai substituen dan alkil sebagai rantai induknya. Benzena sebagai substituen diberi nama fenil– (C6 H5–, disingkat –ph). Contoh:
Gambar 2.27. Benzena Sebagai Substituen
Benzena dengan dua gugus substituen diberi nama dengan awalan: orto– (o–), meta– (m–), dan para– (p–). rto– diterapkan terhadap substituen berdampingan (posisi 1 dan 2), meta– untuk posisi 1 dan 3, dan para– untuk substituen dengan posisi 1 dan 4.
Gambar 2.28 Subtituen pada Metil Benzena
Jika gugus substituen sebanyak tiga atau lebih, penataan nama menggunakan penomoran dan ditulis secara alfabet. Nomor terkecil diberikan kepada gugus fungsional (alkohol, aldehida, atau karboksilat) atau gugus dengan nomor paling kecil.
Urutan prioritas penomoran untuk beberapa substituen yang umum:
Arah tanda panah menunjukkan substituen yang semakin prioritas, maka penomorannya dengan nomor yang semakin kecil
Sedangkan jika terdapat tiga substituen atau lebih pada cincin benzena, maka sistem o, m, p tidak dapat diterapkan lagi dan hanya dapat dinyatakan dengan angka.
Semua senyawa aromatis berdasarkan benzen, C6H6, yang memiliki enam karbon.Setiap sudut dari segienam memiliki atom karbon yang terikat dengan hidrogen.
Gambar 2.29 Penamaan Senyawa Benzena
2.4.2 Trivial
a. Klorobenzen
Ini merupakan contoh sederhana dimana sebuah halogen terikat pada cincin benzen. Penamaan sudah sangat jelas. Penyederhanaannya menjadi C6H5Cl. Sehingga anda dapat (walau mungkin tidak!) menamainya fenilklorida. Setiap kalo anda menggambar cincin benzen dengan sesuatu terikat padanya sebenarnya anda menggambar fenil. Untuk mengikat sesuatu anda harus membuang sebuah hidrogen sehingga menghasilkan fenil.
b. Nitrobenzen
Golongan nitro, NO2, terikat pada rantai benzen.
Gambar 2.30 Nitrobenzen
Formula sederhananya C6H5NO2.
c. Metilbenzen
Satu lagi nama yang jelas. Benzen dengan metil terikat padanya. Golongan alkil yang lain juga mengikuti cara penamaan yang sama.Contoh, etilbenzen. Nama lama dari metilbenzen adalah toluen, anda mungkin masih akan menemui itu.
Gambar 2.31 Metilbenzena
Formula sederhananya C6H5CH3.
d. (Klorometil)benzen
Variasi dari metilbensen dimana satu atom hidrogen digantikan dengan atom klorida. Perhatikan tanda dalam kurung,(klorometil) . Ini agar anda dapat mengerti bahwa klorin adalah bagian dari metil dan bukan berikatan dengan cincin.
Gambar 2.32. Klorometil Benzena
Jika lebih dari satu hidrogen digantikan dengan klorin, penamaan akan menjadi (diklorometil)benzena atau (triklorometil) benzen. Sekali lagi perhatikan pentingnya tanda kurung.
e. asam benzoik (benzenacarboxylic acid)
Asam benzoik merupakan nama lama, namun masih umum digunakan -lebih mudah diucapkan dan ditulis. Apapun sebutannya terdapat asam karboksilik, -COOH, terikat pada cincin benzen.
Gambar 2.33 Asam Benzoat
1. Kasus dimana penamaan berdasarkan Fenil
Ingat bahwa golongan fenil adalah cincin benzen yang kehilangan satu atom karbon – C6H5.
a. fenilamine
Fenilamin adalah amin primer yang mengandung -NH2 terikat pada benzen.
Gambar 2.34. Fenilina
Nama lama dari fenilamin adalah anilin, dan anda juga dapat menamakanya aminobenzena.
b. Fenileten
Molekul eten dengan fenil berikatan padanya. Eten adalah rantai dengan dua karbon dengan ikatan rangap. Karena itu fenileten berupa:
Gambar 2.35 Fenilaten
` Nama lamanya Stiren -monomer dari polystyren.
c. Feniletanon
Mengandung rantai dengan dua karbon tanpa ikatan rangkap. Merupakan golongan adalah keton sehingga ada C=O pada bagian tengah. Terikat pada rantai karbon adalah fenil.
Gambar 2.36 Fenilaton
d. Feniletanoat
Ester dengan dasar asam etanoik. Atom hidrogen pada -COOH digantikan dengan golongan fenil.
Gambar 2.37Feniletanoat
e. fenol
Fenol memiliki -OH terikat pada benzen sehingga formulanya menjadi C6H5OH.
Gambar 2.38Fenol
2.4.3 Senyawa Aromatik dengan lebih dari suatu golongan terikat pada cincin benzen.
Menomori cincin
Salah satu golongan yang terikat pada cincin diberi nomor satu.Posisi yang lain diberi nomor 2 sampai 6. Anda dapat menomorinya searah atau berlawanan arah dengan jarum jam.Sehingga menghasilkan nomor yang terkecil. Lihat contoh untuk lebih jelas
Contoh:
Menambah atom klorin pada cincin
Lihat pada senyawa berikut:
Gambar 2.39 Chloromethylbenzene
Semuanya berdasar pada metilbenzen dan dengan itu metil menjadi nomor 1 pada cincin.
Mengapa 2-Klorometilbenzen dan bukan 6-klorometil benzen? Cincin dinamai searah jarum jamdalam kasus ini karena angka 2 lebih kcil dari angka 6.
asam 2-hidrobenzoik
Juga disebut sebagai asam 2-hidroksibenzenkarbolik. Ada -COOH terikat pada cincin dan karena penamaan berdasarkan benzoik maka golongan benzoik menjadi nomor satu. Pada posisi disampingnya terdapat hidroksi -OH dengan nomor 2.
Gambar 2.40 Asam Benzena-1,4-dikarboksilik
“di” menunjukkan adanya dua asam karboksilik dan salah satunya berada diposidi 1 sedangkan yang lainnya berada pada posisi nomor 4.
Gambar 2.41. Dua Asam Karboksilik
Berdasarkan gambar fenol dengan -OH terikat pada nomor 1 dari rantai karbon dan klorin pada posisi nomor 2,4 dan 6 dari cincin karbon.
Gambar 2.42. 2,4,6-triklorofenol
2,4,6-triklorofenol adalah antiseptik terkenal TCP.
metil 3-nitrobenzoat
Nama ini merupakan nama yang akan anda temui pada soal-soal latihan me-nitrat-kan cincin benzen. Dari namanya ditunjukkan bahwa metil 3-nitrobenzoat merupakan golongan ester (akhiran oat).Dan metil tertulis terpisah.
Ester ini berdasarkan asam T, asam 3-nitrobenzoik -dan kita mulai dari sana.
Akan ada cincin benzen dengan -COOH pada nomor satu dari cincin dan nitro pada nomor 3. untuk menghasilkan ester sebuah hidrogen pada -COOH degantikan dengan metil.
Metil 3-nitrobenzoat menjadi:
Gambar 2.43 Metil 3-nitrobenzoat
Nama trivial asli dari sejumlah senyawa aromatik yang biasa telah diterima oleh IUPAC sebagai nama sistematik. Beberapa nama trivial ditulis pada Tabel 5.1
Ada cukup banyak senyawa aromatik yang ditemukan jauh sebelum metode pemberian nama secara sistematik (IUPAC) digunakan. Oleh karena itu pemberian nama umum yang tanpa aturan yang jelas cukup banyak digunakan hingga sekarang. Beberapa contoh diantaranya adalah:
Gambar 2.44 Contoh Senyawa Aromatik
Jika diperhatikan nama tiga senyawa pertama yaitu benzena, toluene dan stirena, tampak adanya kesamaan. Sebagai satu kelompok senyawa hidrokarbon aromatik tersebut dinamakan arena.
Selain dari nama trivial biasanya kita juga memberi nama aromatik monosubstitusi dengan benzennya sebagai nama induk. Nama substitusi menjadi awalan bagi nama induk. Benzena monosubstitusi dinamakan sebagai turunan benzena, seperti pada gambar berikut:
Gambar 2.45Substitusi Benzena
Dalam hal benzena tersubstitusi dua gugus, ada tiga kemungkinan isomer yaitu isomer orto (o), meta (m) dan para (p). Contohnya adalah:
Gambar 2.46. Isomer Diklorobenzena
Pada beberapa contoh di atas, kedua substituen adalah sama. Awalan orto, meta, dan para tetap digunakan walaupun kedua subtituen berbeda, seperti:
Gambar 2.47 Subtituen Berbagai Turunan Benzena
Cara lain untuk mengetahui letak substituen adalah dengan memberi nomor pada atom karbon penyusun cincin. Metode penomoran ini sangat berguna jika terdapat lebih dari dua substituen, atau dengan sistem ortho, meta, para yang menunjukkan hubungan tempat antara kedua gugusan dalam cincin misalnya:
Gambar 2.48 Subtituen Berbagai Turunan Benzena
Gugus fenil dan benzil sering digunakan pada penamaan senyawa-senyawa aromatik. Struktur kedua gugus tersebut adalah:
Gambar 2.49 Gugus Fenil dan Benzil
Gugus fenil sering dituliskan dengan lambang Ph atau PE. Sedangkan lambang Ar digunakan untuk gugus aril (aromatik). Beberapa contoh disajikan berikut ini:
Gambar 2.50 Gugus Fenil
Gambar 2.51 Bifenil, Benzil Klorida dan m-nitrobenzil Alkohol
Tabel 2.3 Nama Trivial dari Beberapa Benzena yang Bersubstitusi
Rumus bangun Nama Rumus Bangun Nama
2.5Model Resonansi Benzena
Gambar 2.52 Model Resonansi Benzena
— Panjang ikatan karbon-karbon pada benzena adalah sama, yaitu: pertengahan antara panjang ikatan tunggal dan ikatan rangkap.
— Panjang ikatan rangkap C = C adalah 1,34 Å ikatan tunggal C – C adalah 1,53 Å.
— Apabila benzena dianggap mempunyai 3 ikatan rangkap dan 3 ikatan tunggal seperti pada struktur Kekulé, maka akan didapati 3 ikatan yang pendek (1,34 Å) dan 3 ikatan yang panjang (1,53 Å). Akan tetapi analisis dengan difraksi sinar-X menunjukkan bahwa panjang ikatan C – C pada benzena sama, yaitu 1,39 Å.
2.6 Kestabilan Benzena
Berbeda dengan senyawa-senyawa yang mengandung ikatan rangkap lainnya, benzena tidak mudah mengalami reaksi adisi
Tabel 2.4 Perbandingan Reagen, Sikloheksana dan Benzena
| Reagen | Sikloheksena | Benzena |
| KMnO4 encer | Terjadi oksidasi, cepat | Tidak bereaksi |
| Br2/CCl4 (dlm gelap) | Terjadi Adisi, cepat | Tidak bereaksi |
| HI | Terjadi Adisi, cepat | Tidak bereaksi |
| H2 + Ni | Terjadi hidrogenasi, 25oC,20 lb/in.2 | Terjadi hidrogenasi, lambat,100-200oC, 1500 lb/in.2 |
— Kestabilan cincin benzenasecara kuantitatif dapat dilihat dari panas hidrogenasi dan pembakarannya.
— Panas hidrogenasi dan pembakaran benzena lebih rendah dari pada harga perhitungan.
Gambar 2.53 Profil Panas Hidrogenasi Benzena
2.7 Reaksi Pembuatan
1. Memanaskan natrium benzoat kering dengan natrium hidroksida berlebih akan menghasilkan benzena.
Gambar 2.54 Rekasi Natrium Benzoat
2. Mereaksikan asam benzenasulfonat dengan uap air akan menghasilkan benzena.Contoh :
Gambar 2.55 Reaksi Asam Benzenasulfonat
3. Mereduksi fenol dengan logam seng akan menghasilkan benzena.
Contoh:
Gambar 2.56 Reaksi Reduksi Fenol
4. Mengalirkan gas asetilena ke dalam tabung yang panas dengan katalis Fe-Cr-Si akan menghasilkan benzena.
Gambar 2.57 Reaksi Gas Asetilena
2.8 Reaksi Benzena (R. Substitusi)
1. Reaksi Nitrasi
Campuran asam nitrat pekat dan asam sulfat pekat dengan volume sama dikenal sebagai campuran nitrasi. Jika campuran ini ditambahkan ke dalam benzena, akan terjadi reaksi eksotermal. Jika suhu dikendalikan pada 55°C maka hasil reaksi utama adalah nitrobenzena, suatu cairan berwarna kuning pucat. Reaksinya secara umum:
2. Reaksi Sulfonasi
Sulfonasi merupakan reaksi substitusi atom H pada benzena oleh gugus sulfonat. Reaksi ini terjadi apabila benzena dipanaskan dengan asam sulfat pekat sebagai pereaksi.
3. Alkilasi Benzena
Penambahan katalis AlCl3 anhidrat dalam reaksi benzena dan haloalkana atau asam klorida akan terjadi reaksi sangat eksotermis. Jenis reaksi ini dinamakan reaksi Friedel-crafts. Contoh persamaan reaksi:
Gambar 2.58 Alkilasi Benzena
4. Reaksi halogenasi
Gambar 2.59 Reaksi Halogenasi
Sebagai elektrofil adalah X+, dihasilkan dari reaksi antara X2 + FeX3.
FeX3 (misalnya FeCl3) adalah suatu asam Lewis yang berfungsi sebagai katalis. Katalis asam Lewis lain yang dapat digunakan adalah AlCl3, AlBr3.
Contoh:
Gambar 2.60Reaksi Benzena dengan Klorida
5. Reaksi Friedel-Crafts
Reaksi Friedel-Crafts meliputi reaksi alkilasi dan reaksi asilasi.
Reaksi alkilasi:
Gambar 2.61 Reaksi Alkilasi Fidel Craft
Sebagai elektrofil dalam reaksi alkilasi Friedel-Crafts adalah ion karbonium (R+).Karena melibatkan ion karbonium, maka seringkali terjadi reaksi penyusunan ulang (rearrangement) membentuk karbonium yang lebih stabil.
Contoh reaksi alkilasi:
Gambar 2.62 Reaksi Alkilasi Fidel Craft
Reaksi asilasi:
Gambar 2.63 Reaksi Asilasi
Sebagai elektrofil dalam reaksi asilasi Friedel-Crafts adalah ion asilium, terbentuk dari hasil reaksi:
Gambar 2.64 Reaksi dengan Ion Asilium
Ion asilium
Pada reaksi asilasi Friedel-Crafts tidak terjadi reaksi penataan ulang.Dalam reaksi alkilasi dan asilasi Friedel-Crafts juga digunakan katalis asam Lewis, misalnya FeCl3, FeBr3, AlCl3, AlBr3.
Contoh reaksi asilasi:
Gambar 2.65 Reaksi Asilasi
Jadi, dapat disimpulkan benzena lebih mudah mengalami reaksi substitusi daripada reaksi adisi.
2.9 Reaksi Subtitusi Benzena dengan senyawa lain
Substitusi Elektrofilik Aromatik
Perbedaan sifat kimia antara struktur aromatik dengan struktur konjugasi rantai terbuka terlihat dari reaksinya terhadap halogen. Sistem aromatik mengalami reaksi substitusi sedangkan sistem konjugasi ploena mengalami reaksi adisi.
Beberapa contoh reaksi substitusi terhadap benzena adalah sebagai berikut:
Gambar 2.66 Subtitusi Benzena
Mekanisme Substitusi Elektrofilik Aromatik
Ditinjau reaksi klorinasi benzen berikut:
Dalam reaksi ini, klor digunakan sebagai sumber elektroifil, sedangkan feriklorida yang merupakan asam Lewis sebagai katalisator.
Tahap pertama dari reaksi klorinasi tersebut adalah pembentukan elektrofil dari klor. Reaksinya adalah:
Pada tahap kedua terjadi serangan elektrofil berupa ion kloronium tersebut terhadap cincin benzena, persamaannya:
Gambar 2.67Feril Klorida
Sebagai hasil adalah terbentuknya karbokation. Orbital kosong dari karbokation segera membentuk ikatan terdelokalisasi dengan orbital p atom karbon lain pada cincin seperti halnya ikatan terdelokalisasi pada ion afilik. Struktur ikatan terdelokalisasi yang bermuatan positif ini disebut ion benzenonium. Struktur hibrida resonansinya dituliskan sebagai berikut:
Gambar 2.68 Struktur Hibrida Resonansi
Ion feCl4 yang terbentuk pada tahap pertama berada dalam keadaan kesetimbangan dengan ion klorida sesuai persamaan berikut:
Gambar 2.69Feriklorida
Adanya nukleofil berupa ion klorida tersebut menyebabkan lepasnya satu proton, dan terbentuk lagi sistem terdelokalisasi cincin benzena, persamaannya:
Gambar 2.70Delokalisasi Cincin Benzena
Beberapa macam elektrofil disajikan dalam Tabel 2.5 di bawah ini:
Tabel 2.5 Elektrofil Umum pada Substitusi Aromatik
| Elektrofil | Nama | Proses |
| Cl+Br+NO2+SO3 atau SO3H+R+ | Ion KloroniumIon bromoniumIon nitroniumIon sulfat trioksida (terprotonasi)Ion karbonium | KlorinasiBrominasiNitrasiSulfonasiAlkilasi |
§ Substituen Pengaktif dan Pen-Deaktif Cincin
Diketahui struktur beberapa senyawa sebagai berikut:
Gambar 2.71 Beberapa Senyawa Benzena
Data kecepatan reaksi nitrasi (campuran HNO3 dan H2SO4) senyawa-senyawa di atas relatif terhadap benzena adalah sebagai berikut:
Toluena = 24,5
Benzena = 1,0
Klorobenzena = 0,003
Nitrobenzena = 0,0000001
Kesimpulan dari fakta tersebut adalah bahwa gugus –CH3 bersifat mengaktifkan cincin benzena terhadap substitusi elektrofilik, sedangkan gugus klor dan nitro bersifat mendeaktifkan cincin benzena terhadap reaksi elektrofilik. Gugus seperti CH3 disebut gugus pengaktif cincin, sedangkan gugus seperti klor dan nitro disebut gugus pendeaktif cincin benzena.
§ Gugus Pengarah Orto, Para Dan Meta
Apabila toluene dinitrasi maka NO2+ menyerang sebagian besar pada posisi orto dan para, sebaliknya hanya sedikit yang menyerang pada posisi meta. Reaksinya adalah:
Gambar 2.72Reaksi Toluena
Terlihat bahwa produk orto dan para lebih dominan dari pada meta. Dapatkah teori Kimia Organik menerangkan kenyataan ini?
Diketahui bahwa pada reaksi ini terbentuk zat antara reaktif yang disebut ion benzenonium. Postulat Hammond menyatakan bahwa arah dari reaksi ditentukan oleh kestabilan ion benzenonium, ion benzenonium yang terjadi pada serangan orto, para, dan meta sebagai berikut:
Serangan orto, para :
Gambar 2.73 Serangan Orto dan Para pada Toluena
Serangan meta :
Gambar 2.74Serangan Meta pada Toluena
Dari gambar di atas dapat dilihat bahwa ion benzenonium pada penyerangan orto dan para mempunyai hibrida resonansi dengan karbokation tersier. Hal ini tidak terjadi pada serangan meta. Dapat diartikan bahwa ion benzenonium yang terbentuk pada penyerangan orto-para lebih stabil daripada ion benzenonium pada penyerangan meta. Berdasar pada postulat Hammond, penyerangan orto-para haruslah dominan.
Selanjutnya ditinjau reaksi brominasi nitrobenzene dengan reaksi berikut:
Gambar 2.75 Reaksi Nitrobenzena
Hibrida resonansi dari ion benzenonium yang terbentuk pada serangan orto, para dan meta dapat digambarkan sebagai berikut:
Serangan meta :
Gambar 2.76Serangan Meta pada Nitrobenzena
Serangan orto, para :
Gambar 2.77 Serangan Orto dan Para pada Nitrobenzen
Terlihat bahwa ion benzenonium yang terbentuk pada serangan orto dan para memiliki karbon positif yang berikatan langsung dengan atom N yang bermuatan positif pula. Struktur demikian adalah kurang stabil karena menyebabkan lemahnya ikatan C – N. Hal serupa tidak dijumpai pada penyerangan meta. Sehingga dapat disimpulkan bahwa ion benzenanonium pada penyerangan meta bersifat lebih stabil. Dengan mengacu pada prinsip Hammond di atas, maka penyerangan orto, para dan meta disajikan dalam tabel di bawah ini.
Tabel 2.6 Gugus Fungsi Pengarah
| Pengarah orto, para | Pengarah meta |
| -CH3, CH2 CH3 (alkil)-F, -Cl, -Br, -I-OH, -OCH3, -OR-NH2, -NHR, -NR2 | -NO2, -SO3H-COR, -CO2H, -CO2R-CoN |
Berkaitan dengan uraian di atas, gugus pengarah orto dan para umumnya adalah gugus pengaktif cincin, Sedangkan gugus pengarah meta adalah gugus pendeaktif cincin.
Perkecualian untuk gugus berupa atom halogen (F, Cl, Br dan I), halogen adalah pengarah orto dan para namun bersifat mendeaktifkan cincin.
a. Pentingnya Gugus Pengarah Dalam Sintesis
Fungsi gugus pengarah dan pengaktif cincin adalah penting dalam merancang sintesis bertahap yang melibatkan substitusi aromatik. Sebagai contoh diberikan soal berikut:
Rancangan sintesis senyawa-senyawa berikut, dimulai dengan benzena!
a. asam m-klorobenzenasulfonat
b. p=nitrotoluena
Jawab:
a. Pembuatan asam m-klorobenzenasufonat dari benzena dimulai dengan reaksi sulfonasi terlebih dahulu, selanjutnya diikuti klorinasi. Hal ini dikerjakan mengingat gugus sulfonat adalah gugus pengarah meta, sehingga klor akan terikat pada posisi meta. Sebagai hasil dapat diperoleh senyawa seperti yang diharapkan.
Gambar 2.78 Struktur Pembuatan Asam m-Klorobenzenasulfonat
Reaksi di atas tidak dapat dibalik, seandainya dibalik yaitu klorinasi terlebih dahulu kemudian diikuti dengan sulfonasi maka akan terbentuk senyawa berbeda, yaitu asam orto dan para-klorobenzenasulfonat. Hal ini dapat terjadi karena klor adalah gugus pengarah orto dan para.
b. Mengingat metil adalah gugus orto dan para, maka sintesis p-nitrotoluena dikerjakan dengan alkilasi terlebih dahulu, kemudian diikuti dengan nitrasi.
Reaksinya adalah sebagai berikut:
Gambar 2.79 Sintesis p-Nitrotoluena
Dalam hal ini hasil yang diperoleh merupakan campuran hasil substitusi orto dan para.
Jika ada dua gugus yang telah terikat pada cincin maka dalam rangka pengikatan gugus ketiga, antara keduanya dapat saling menguatkan atau saling melemahkan, tergantung pada jenis gugus yang ada tersebut.
b. Hidrokarbon Aromatik Polisiklik
Pada uraian yang terdahulu telah disebutkan konsep aromatik yaitu kestabilan yang tinggi dari sistem siklik pada benzena dan turunannya. Pada senyawa-senyawa yang telah diterangkan di atas hanya terdapat sebuah cincin siklik. Naftalena dengan rumus molekul C10H8, adalah senyawa aromatik polisiklik yang banyak ditemui dalam ter batubara. Struktur naftalena merupakan bidang datar dengan dua cincin benzena yang menyatu. Kedua cincin tersebut menggunakan bersama dua buah atom karbon. Salah satu struktur hibrida resonansinya.
Atas dasar konsep struktur delokal tersebut di atas maka resonansi hibrida naftalena dapat dituliskan sebagai berikut:
Gambar 2.80Resonansi Hibrida Naftalena
Hal ini berarti bahwa naftalena dapat menyerupai struktur alkena terbuka. Atas dasar itulah maka dapat diperkirakan bahwa naftalena lebih reaktif dari pada benzena. Beberapa senyawa aromatik polisiklik yang umum dapat dilihat pada Tabel 2.7 dan Tabel 2.8
Tabel 2.7 Senyawa Aromatik Polisiklik
Tabel 2.8 Senyawa Aromatik Polisiklik
c. Senyawa Aromatik Heterosiklik
Pada bagian ini akan diperkenalkan jenis senyawa aromatik yang penyusun cincin siklisnya bukan atom karbon saja, melainkan juga terdapat atom lain.
Atom yang sering ditemui antara lain nitrogen, oksigen, dan belerang. Perhatikan struktur berikut:
Gambar 2.81Piridin dan Pirol
Pada kedua senyawa di atas, nitrogen dalam keadaan hibrida sp2. Lima atom karbon pada piridin masing-masing menyumbang 1 (satu) electron p, sehingga untuk memenuhi jumlah 6 elektron p dibutuhkan satu elektron dari atom N. Satu elektron ini berasal dari orbital p yang tegak lurus pada orbital sp2. Dengan demikian, satu orbital sp2 terisi dua electron dari atom N tidak termasuk pada sistem delokal. Sebagai akibat orbital sp2 terisi dua elektron tersebut, dia dapat menerima proton dari asam membentuk garam ataupun membentuk ikatan hidrogen dengan air.
Sedang pada pirol hanya ada 4 atom karbon dalam keadaan sp2, sehingga untuk melengkapi jumlah 6 elektron p, atom nitrogen harus menyumbang dua electron. Untuk itu atom N harus berada dalam keadaan sp2 dengan orbital p terisi dua elektron yang tegak lurus pada bidang. Ketiga orbital sp2 dari atom N terikat oleh dua tom C dan satu atom H. Karena itulah kebasaan pirol lebih lemah disbanding piridin.
Beberapa senyawa aromatik kelompok piridin, dimana heteroatomnya hanya menyumbangkan satu elektron kepada sistem aromatik diantaranya adalah:
Gambar 2.82Pirimidin, Kuinolin dan Isokuinolin
Sedangkan beberapa contoh senyawa aromatik kelompok pirol dimana heteroatomnya hanya menyumbangkan dua electron kepada sistem delokal, diantaranya adalah:
Gambar 2.83 Imidazol, Indol, Furan dan Tiofen
2.10 Kegunaan dan Dampak Senyawa Aromatis
2.10.1 Kegunaan Senyawa Aromatis
1. Benzena digunakan sebagai pelarut.
2. Benzena juga digunakan sebagai prekursor dalam pembuatan obat, plastik, karet buatan dan pewarna.
3. Benzena digunakan untuk menaikkan angka oktana bensin.
4. Benzena digunakan sebagai pelarut untuk berbagai jenis zat. Selain itu benzena juga digunakan sebagai bahan dasar membuat stirena (bahan membuat sejenis karet sintetis) dan nilon–66.
5. Asam Salisilat
Asam salisilat adalah nama lazim dari asam o–hidroksibenzoat. Ester dari asam salisilat dengan asam asetat digunakan sebagai obat dengan nama aspirin atau asetosal.
6. Asam Benzoat
Asam benzoat digunakan sebagai pengawet pada berbagai makanan olahan.
7. Anilina
Anilina merupakan bahan dasar untuk pembuatan zat-zat warna diazo. Reaksi anilina dengan asam nitrit akan menghasilkan garam diazonium, dan proses ini disebut diazotisasi.
8. Toluena
Kegunaan toluena yang penting adalah sebagai pelarut dan sebagai bahan baku pembuatan zat peledak trinitrotoluena (TNT)
9. StirenaJika stirena mengalami polimerisasi akan terbentuk polistirena, suatu jenis plastik yang banyak digunakan untuk membuat insulator listrik, bonekaboneka, sol sepatu, serta piring dan cangkir.
10. Benzaldehida
Benzaldehida digunakan sebagai zat pengawet serta sebagai bahan baku pembuatan parfum karena memiliki bau yang sedap.
11. Natrium Benzoat
Seperti asam benzoat, natrium benzoat juga digunakan sebagai bahan pengawet makanan dalam kaleng.
12. Fenol
Fenol (fenil alkohol) dalam kehidupan sehari-hari lebih dikenal dengan nama karbol atau lisol, dan dipergunakan sebagai zat disinfektan (pembunuh bakteri) karena dapat menyebabkan denaturasi protein
Toluena
Toluena digunakan sebagai pelarut dan sebagai bahan dasar untuk membuat TNT (trinitotoluena), senyawa yang digunakan sebagai bahan peledak (dinamit) seperti terlihat pada Gambar 2.84
Gambar 2.84 Reaksi pembuatan TNT dari toluena
Stirena
Stirena digunakan sebagai bahan dasar pembuatan polimer sintetik polistirena melalui proses polimerisasi. Polistirena banyak digunakan untuk membuat insolator listrik, boneka, sol sepatu serta piring dan cangkir. Struktur polistirena dapat dilihat pada Gambar 2.85
| Gambar 2.85 Struktur Polistirena |
Anilina
Anilina merupakan bahan dasar untuk pembuatan zat-zat warna diazo.Anilina dapat diubah menjadi garam diazonium dengan bantuan asam nitrit dan asam klorida.Reaksi pembentukan garam diazonium klorida dapat dilihat pada Gambar 2.86
Gambar 2.86 Reaksi pembentukan garam diazonium klorida
Garam diazonium selanjutnya diubah menjadi berbagai macam zat warna. Salah satu contohnya adalah Red No.2 yang memiliki struktur seperti dapat dilihat pada Gambar 2.87
| Gambar 2.87Struktur Zat Pewarna Red No.2 |
Red No.2 pada awalnya digunakan seabagai pewarna minuman, tetapi ternyata bersifat sebagai mutagen.Oleh karena itu, sekarang Red No.2 hanya digunakan sebagai pewarna wol dan sutera.
Benzaldehida
Benzaldehida digunakan sebagai zat pengawet serta bahan baku pembuatan parfum karena memiliki bau yang khas. Benzaldehida dapat berkondensasi dengan asetaldehida (etanal), untuk menghasilkan sinamaldehida (minyak kayu manis). Reaksi pembentukan sinamaldehide dari benzaldeide dapat dilihat pada Gambar 2.88
Gambar 2.88 Reaksi pembentukan sinamaldehide dari benzaldeide
Fenol
Dalam kehidupan sehari-hari fenol dikenal sebagai karbol atau lisol yang berfungsi sebagai zat disenfektan.
Asam Benzoat dan Turunannya
Terdapat beberapa turunan dari asam benzoat yang tanpa kita sadari sering kita gunakan, diantaranya adalah:
• Asam asetil salisilat atau lebih dikenal dengan sebutan aspirin atau asetosal yang biasa digunakan sebagai obat penghilang rasa sakit (analgesik) dan penurun panas (antipiretik). Oleh karena itu aspirin juga digunakan sebagai obat sakit kepala, sakit gigi, demam dan sakit jantung.Penggunaan dalam jangka panjang dapat menyebabkan iritasi lapisan mukosa pada lambung sehingga menimbulkan sakit maag, gangguan ginjal, alergi, dan asma. Struktur molekul asam asetil salisilat dapat dilihat pada Gambar 2.89
| Gambar 2.89 Asam asetil salisilat |
• Natrium benzoat yang biasa digunakan sebagai pengawet makanan dalam kaleng. Struktur molekul natrium benzoat dapat dilihat pada Gambar 2.89.
| Gambar 2.90Natrium Benzoat | |
• Metil salisilat adalah komponen utama obat gosok atau minyak angin. Struktur molekul metil salisilat dapat dilihat pada Gambar 2.91
| Gambar 2.91 Metil Salisilat |
• Asam tereftalat merupakan bahan serat sintetik polyester. Struktur molekul asam tereftalat dapat dilihat pada Gambar 2.92
| Gambar 2.92 Asam Tereftalat |
• Parasetamol (asetaminofen) memiliki fungsi yang sama dengan aspirin tetapi lebih aman bagi lambung. Hampir semua obat yang beredar dipasaran menggunakan zat aktif parasetamol.Penggunaan parasetamol yang berlebihan dapat menimbulkan gangguan ginjal dan hati. Struktur molekul parasetamol dapat dilihat pada Gambar 2.93
| Gambar 2.93 Parasetamol |
2.10.2 Dampak senyawa benzena
1. Benzena sangat beracun dan menyebabkan kanker (karsinogenik).
2. Benzena dapat menyebabkan kematian jika terhirup pada konsentrasi tinggi, sedangkan pada konsentrasi rendah menyebabkan sakit kepala dan menaikkan detak jantung.
2.11 Info Terkini
Bahaya hidupkan AC saat mobil baru berjalan
Tahukah anda menghidupkan AC pada mobil yang baru saja dihidupkan ternyata mengundang bahaya ?
Perlu kita ketahui bahwa udara yang ada di dalam mobil (saat parkir) mengandung Benzena/Benzol.Darimanakah Benzena itu berasal? Menurut penelitian yang dilakukan oleh UC dashboard mobil, sofa, air freshener akan memancarkan benzene, hal ini disebabkan oleh suhu ruangan yang meninggi .
Tingkat benzene yanag dapat diterima dalam ruangan adalah 50 mg per sq ft. sebuah mobil yang parkir diruangan dengan jendela tertutup akan berisi 400-800 mg dari benzena, itu berarti banyak sekali. Jika parkir di luar rumah dibawah sinar matahari pada suhu diatas 600 F, tingkat benzena itu berjalan sampai 2000-4000 mg, itu sama saja 40 kali dengan tingkat yang dapat diterima.
Bahaya benzena efek singkat menghirup high level benzena dapat menyebabkan kematian, sedangkan menghirup low level benzena dapat menyebabkan kantuk, pusing, mempercepat denyut jantung, sakit kepala, tremors, dan ketidaksadaran.
Long term efeknya bisa menyebabkan kerusakan pada sumsum tulang dan dapat menyebabkan penurunan sel darah merah yang mengarah ke anemia.benzena dapat juga menyebabkan pendarahan yang berlebihan dan menurunkan sistem kekebalan tubuh, meningkatkan kesempatan infeksi, menyebabkan leukemia dan lainsebagainya yang terkait dengan kanker darah dan pra-kanker dari darah.
Lalu bagaimana cara mengatasinya ?
Buka kaca mobil anda sebelum mengendarai mobil dan jangan terburu-buru menyalakan AC, hal ini dilakukan agar udara yang ada didalam mobil bisa segera keluar dan tergantikan dengan udara yang lebih segar.
BAB III
SOAL DAN PEMBAHASAN
1. Bagaimana Benzena bisa menaikkan bilangan oktan bensin?( Toni Arissaputra)
Kualitas bensin dinyatakan oleh bilangan oktan. Semakin tinggi bilangan oktan, maka semakin tinggi pula kualkitas bensin tersebut. Dalam kata lain bilangan oktan merupakan ukuran dari kemampuan bahan bakar untuk mengatasi ketukan sewaktu terbakar dalam mesin. Menambahkan zat aditif anti ketukan ke dalam bensin untuk memperlambat pembakaran bensin. Dahulu digunakan senyawa timbal (Pb). Namun karena Pb bersifat racun, maka penggunaannya sudah dilarang dan diganti dengan senyawa organik, seperti etanol dan MTBE (Methyl Tertiary Butyl Etter). Terkadang penggunaan Pb digantikan oleh senyawa benzena, sehingga kadar benzena dalam bensin semakin meningkat. Alasan dari penambahan ini adalah karena benzen dapat mengurangi ketukan yag terjadi saat pembakaran, sehingga kualitas bensin yang diperoleh bagus dalam artian bilangan oktannya tinggi.
2. Jelaskan proses pembuatan stirena ?(ikhsan fajrin)
Stirena dibuat dari subtitusi CH2=CH2 pada molekul benzena dengan katalis AlCl3 dicampur dengan HCl pada suhu 95° C
Etil benzena kemudian dipanaskan pada suhu 600°C dengan katalis logam Zn. Logam Zn berfungsi sebagai dehidrogenasi gugus etil.
3. Sebutkan contoh yang mana saja nama menurut aturan IUPAC dan Trivial ?(Rio Saputra)
1. IUPAC
Contohnya : Hidroksibenzena, Aminobenzena dan Nitrobenzena Butilbenzena dan Isopropilbenzena
2. Trivial
Contohnya : Klorobenzen,nitrobenzen,metilbenzen,klorometilbenzen,dll
4. Sebutkan persyaratan senyawa aromatis?
Tidak semua senyawa yang memiliki ikatan rangkap yang berselangseling dengan ikatan tunggal (memiliki ikatan rangkap terkonjugasi) dapat digolongkan sebagai senyawa aromatis dan yang termasuk senyawa aromatis syaratnya adalah:
ü molekul harus siklik dan datar.
ü memiliki orbital p yang tegak lurus pada bidang cincin (memungkinkan terjadinya delokalisasi elektron pi) bila tidak , tidak mungkin terjadi delakolasi penuh electron Phi.
ü Memiliki elektron pi = 4n + 2 (aturan Huckle) n = bilangan bulat.
5. Apa saja yang menjadi urutan prioritas pada penentuan subtituen?
Urutan prioritas penomoran untuk beberapa substituen yang umum:
Arah tanda panah menunjukkan substituen yang semakin prioritas, maka penomorannya dengan nomor yang semakin kecil
6. Mengapa elektron elektron dalam molekul benzena selalu terdelokalisasi yang menyebabkan kestabilan struktur cincin benzena?
Terjadinya delokalisasi elektron dalam molekul benzena ini disebabkan oleh adanya orbital-orbital p bebas pada setiap atom C. Orbital p yang bebas ini arahnya tegak lurus terhadap cincin awan elektron yang mengapit cincin benzena disebelah atas dan bawahnya. Kestabilan cincin benzena ini didukung oleh fakta lebih mudahnya terjadi reaksi subtitusi pada benzena daripada reaksi adisi.
7. Apa saja turunan dari senyawa benzena?
1) Toluena digunakan untuk membuat bahan peledak trinitro toluena(TNT)
2) Fenol digunakan sebagai bahan untuk membuat karbol,pembuatan iodin,insektisida,bahan pencelup,dan bahan dasar obat obatan seperti aspirin
3) Anilina digunakan sebagai bahan dasra pembuatan zat warna,bahan bakar roket,dan sebagai bahan peledak
4) Asam benzoat digunakan sebagai pengawet bahan makanan dan minuman
5) Asam salisilat digunakan untuk pembuatan talk salisil spritus
6) Stirena digunakan sebagai bahan dasar pembuatan jenis plastik yang dikenal dengan nama polistirena
BAB IV
KESIMPULAN DAN SARAN
4.1 Kesimpulan
Kesimpulan dari penjelasan diatas dapat disimpulkan bahwa senyawa Benzena memilki Rumus Molekul C6H6 dan termasuk dalam golongan senyawa Hidrokarbon Aromatik. Dari rumus molekulnya dapat diketahui bahwa benzena merupakan senyawa tidak jenuh karena tidak memenuhi rumus CnH2n+2.Benzena memiliki enam atom C dan enam atom H,dan memiliki derajat ketidakjenuhan yang tinggi. Dilihat dari struktur resonansi benzena,ikatan tunggal dan ikatan rangkap antara dua atom C bergerak dinamis(berputar) berganti gantian.
Menurut Friedrich August Kekule, keenam atom karbon pada benzena tersusun secara siklik membentuk segienam beraturan dengan sudut ikatan masing-masing 120°. ikatan karbon-karbon pada molekul benzena berada di antara ikatan rangkap dua dan ikatan tunggal karena terkonjugasi. Di samping benzena dan turunannya, ada beberapa jenis senyawa lain yang menunjukkan sifat aromatik, yaitu mempunyai ketidakjenuhan tinggi dan tidak menunjukkan reaksi-reaksi seperti alkena
Senyawa benzena sukar melakukan reaksi adisi bahkan lebih mudah melakukan reaksi subtitusi. Oleh sebab itulah maka dkembangkan model benzena yang ikatan rangkapnya dapat berpindah pindah tempat(resonansi). Jadi ketika benzena diadisi,elektronnya akan berpindah sehingga menghasilkan struktur molekul yang tetap sama seperti sebelum elektron berpindah. Peristiwa ini disebut resonansi.
Elektron elektron ikatan dalam molekul benzena selalu terdelokalisasi yang menyebabkan kestabilan struktur cincin benzena. Terjadinya delokalisasi elektron dalam molekul benzena ini disebabkan oleh adanya orbital p bebas pada setiap atom C.
Senyawa aromatis banyak diaplikasikan dikehidupan sehari hari,baik dalam rumah tangga maupun dalam skala industri. Salah satu contoh penerapan senyawa aromatis yang sering dipakai dalam kehidupan sehari hari yaitu asam benzoat sebagai pengawet makanan dan minuman. Selain memberikan manfaat dalam kehidupan sehari hari,senyawa aromatis juga memberikan dampak yang sangat merugikan manusia,salah satu dampaknya adalah bersifat karsinogenik.
4.2 Saran
Dalam menggunakan senyawa benzena harus berhati hati karena benzena dapat menyebabkan karsionegik dan kematian,oleh sebab itu dalam penggunaan nya harus seperlunya digunakan.
DAFTAR PUSTAKA
Anonim. 2011.Benarkah Kekule Menetapkan Rumus Inti Benzena Hanya Berdasarkan Mimpi.http://dc314.4shared.com. 17 desember 2012
Anonim.2011. Penamaan Senyawa Aromatis.
http://chemistry-family.blogspot.com. 17 desember 2012
Anonim.2010. Benzena.http://tadriskimia.blogspot.com.17 desember 2012
Justina,Sandi. 2009. Ilmu Kimia Jilid 3.Jakarta : Yudhistira
Karamy,Irvan. 2010. Benzena dan derivatnya. Fakultas Teknik Universitas Sriwijaya. Palembang.
Kartini dkk.2007.Sains Kmia 3 SMA/MA.Jakarta :Bumi Aksara
Liliasari. 1995. Kimia 3. Jakarta: Departemen Pendidikan dan Kebudayaan.
Purba,michael. 2001. Kimia 2000 Jilid 3A. Jakarta: Erlangga
Riswiyanto.2009.Kimia Organik.Jakarta : Erlangga
Stresna,nana. 2001. Penuntun Pelajaran Kimia Jilid 3. Jakarta: Grafindo.
Tonnyangga. 2011. Benzena Dan Turunannya. Benzena Dan Turunannya Tonnyangga Weblog.Htm.17 desember 2012.
Zulfikar. 2010. Sifat-Sifat Benzena Dan Turunannya. Sifat-Sifat Benzen Dan Turunannya.chem-is-try.org situs kimiia indonesia_.htm.17 desember 2012.
Leave a Reply
You must be logged in to post a comment.