Berikut ini adalah contoh laporan praktikum kimia dengan judul Senyawa Asam Karbosilat dan Ester. Praktikum untu bertujuan untuk mengetahui cara pembuatan senyawa ester.
Daftar isi
Senyawa Asam Karbosilat dan Ester
Bab I. Pendahuluan
A. Latar Belakang
Ester merupakan senyawa yang penting dalam industri dan secara biologis. Ester yang merupakan turunan asam karboksilat yang mana gugus – OH pada asam karboksilat (RCOOH) diganti menjadi gugus –R ( alkil ) sehingga menjadi ester dengan rumus RCOOR. Ester terdapat pada hampir semua makhluk hidup terutama tumbuh-tumbuhan. Ester mempunyai sifat kimia yang sangat khas yaitu berbau cukup menyengat terutama berbau harum, sehingga ester banyak diproduksi oleh makhluk hidup untuk menarik lawan jenis maupun untuk membantu metabolisme dan aktivitasnya terutama pada tumbuh-tumbuhan yang digunakan untuk menarik serangga untuk membantu penyerbukan yang mana bau tersebut berasal dari campuran yang kompleks dari ester volatil. Oleh karena sifatnya itu ester banyak dimanfaatkan oleh manusia, baik yang diekstrak langsung dari tumbuh-tumbuhan dan hewan ataupun disintetis melalui reaksi-reaksi kimia.
Etil asetat merupakan cairan tidak berwarna yang mempunyai berat molekul 88.12 g/mol dengan rumus molekulnya adalah C4H5O2. Senyawa ini adalah hasil reaksi dari asam karboksliat dan alkohol dengan bantuan katalis berupa asam sulfat pekat. Zat ini merupakan pelarut polar menengah yang volatile (mudah menguap) tidak beracun dan tidak higroskopis. Etil asetat dapat melarutkan air hingga 3% dan larut dalam air hingga kelarutan 8% pada suhu kamar. Kelarutannya semakin meningkat pada suhu yang lebih tinggi. Namun demikian, senyawa ini tidak stabil dalam air yang mengandung basa atau asam. Etil asetat sering disingkat EtOAc, dengan Et mewakili gugus etil san OAc mewakili asetat. Etil asetat diproduksi dalam skala besar sebagai pelarut. Etil asetat dibuat melalui reaksi Esterifikasi Fisher dari asam asetat dan etanol. Reaksi esterifikasi adalah reaksi pembentukan ester dengan cara merefluks sebuah asam karboksilat bersama alkohol dengan katalis asam.Etil asetat disintesis melalui reaksi esterifikasi Fischer dari asam asetat dan etanol, biasanya disertai katalis asam seperti asam sulfat.
CH3CH2OH + CH3COOH → CH3COOCH2CH3+ H2O
Reaksi diatas merupakan reaksi reversibel dan menghasilkan suatu kesetimbangan kimia. Karena itu, rasio hasil dari reaksi diatas menjadi rendah jika air yang terbentuk tidak dipisahkan. Di laboratorium, produk etil asetat yang terbentuk dapat dipisahkan dari air dengan menggunakan aparatus Dean-Stark. Etil asetat dapat dihidrolisis pada keadaan asam atau basa menghasilkan asam asetat dan etanol kembali. Katalis asam seperti asam sulfat dapat menghambat hidrolisis karena berlangsungnya reaksi kebalikan hidrolisis yaitu esterifikasi Fischer. Untuk memperoleh rasio hasil yang tinggi, biasanya digunakan asam kuat dengan proporsi stoikiometris, misalnya natrium hidroksida.Etil asetat merupakan salah satu jenis pelarut yang memiliki rumus molekul CH3COOC2H5.
Produk turunan dari asam asetat ini memiliki banyak kegunaan serta pasar yang cukup luas seperti pengaroma buah dan pemberi rasa seperti untuk es krim, kue, kopi, teh atau juga untuk parfum, digunakan pada industri tinta cetak, cat dan tiner, lem, PVC film, polimer cair dalam industri kertas, serta banyak industri penyerap lainnya seperti industri farmasi, dan sebagainya.Pada skala industri, etil asetat diproduksi dari reaksi esterifikasi antara asam asetat (CH3COOH) dan etanol (C2H5OH) dengan bantuan katalisdalam suasana asam (H2SO4).
B. Tujuan Praitkum
- Mengetahui senyawa ester dan asam karboksilat
- Memahami cara pembentukan ester
Bab II. Landasan Teori
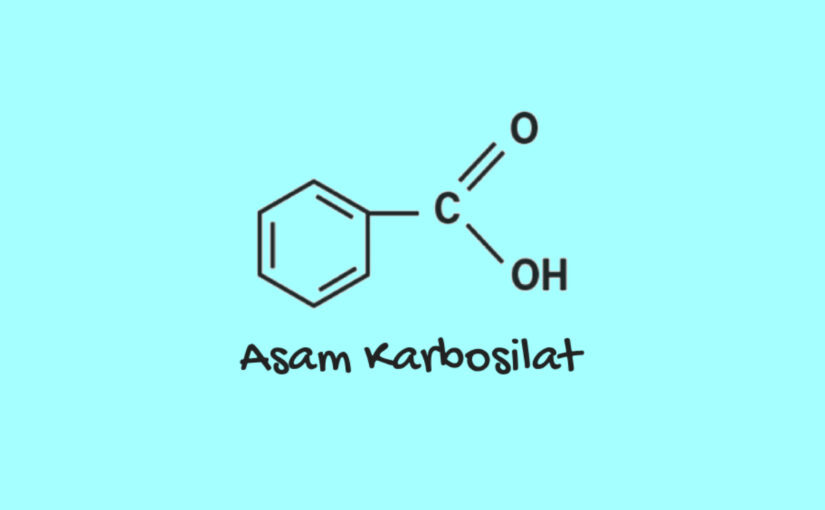
A. Asam Karbosilat
Ester diturunkan dari asam karboksilat dengan mengganti gugus OH dengan gugus OR (R adalah gugus alkil atau aril). Ester merupakan senyawa organik yang bersifat netral, tidak bereaksi dengan logam Na dan PCl3. Ester termasuk salah satu turunan asam karboksilat yang diperoleh dengan mereaksikan suatu asam (karboksilat) dengan alkohol atau phenol. Rumusnya: RCOOR’ dimana R dan R’ adalah gugus organik.
Ester yang terrdiri dari asam-asam yang berat molekul rendah dan alkohol merupakan senyawa-senyawa cair yang tidak berwarna, sedikit larut dalam air dengan bau semerbak, dan mudah menguap. Ester dari beberapa asam karboksilat dengan rantai panjang terdapat secara alamiah di dalam lemak,lilin, dan minyak.
Tabel 2.1 Rumus Umum dan Struktur Asaam Karboksilat dan Ester
| Kelompok Senyawa | Gugus Fungsi | Rumus Umum |
| Asam Karboksilat | -COOH | R-COOH |
| Ester | -COO- | R-COOR’ |
B. Sifat-sifat Ester
I. Sifat-sifat Fisika Ester
Sifat sifat ester secara fisika yaitu :
- Senyawa cair yang tidak berwarna
- Sedikit larut dalam air
- Bau semerbak
- Mudah menguap
II. Sifat Kimia Ester
Sifat sifat kimia yang dimiliki oleh ester adalah :
- Pada umumnya mempunyai bau yang harum, menyerupai bau buah-buahan
- Senyawa ester pada umumnya sedikit larut dalam air
- Ester lebih mudah menguap dibandingkan dengan asam atau alkohol pembentuknya
- Ester merupakan senyawa karbon yang netral
- Ester dapat mengalami reaksi hidrolisis
- Ester dapat direduksi dengan H2 menggunakan katalisator Ni dan dihasilkan dua buah senyawa alkohol
- Ester khususnya minyak atau lemak bereaksi dengan basa membentuk garam sabun) dan gliserol. Reaksi ini dikenal dengan reaksi safonifikasi/penyabunan.
- Hidrolisis Ester dapat terhidolisis dengan pengaruh asam membentuk alkohol dan asam karboksilat. Reaksi hidrolisis merupakan kebalikan dan pengesteran. Hidrolisis lemak atau minyak menghasilkan gliserol dan asam-asam lemak. Contoh hidrolisis gliseril tristearat menghasilkan gliserol dan asam stearat.
Contoh :
R–COOR’ + H2O → R –COOH + R’OH
Ester → Asam Alkanoat + Alkohol
Penamaan ester hampir menyerupai dengan penamaan basa.walaupun tidak benar-benar mempunyai kation dan anion, namun memiliki kemiripan dalam sifat lebih elektropositif dan keelektronegatifan. Suatu ester dapat dibuat sebagai produk dari suatu reaksi pemadatan pada suatu asam (pada umumnya suatu asam organik) dan suatu alkohol atau campuran zat asam karbol,walaupun ada cara-cara lain untuk membentuk ester. Pemadatan adalah suatu jenis reaksi kimia di mana dua molekul bekerja sama dan menghapuskan suatu molekul yang kecil, dalam hal ini dua gugus OH yang merupakan hasil eliminasi suatu molekul air.
Pembentukan ester melalui asilasi langsung asam karboksilat terhadap alkohol, seperti pada esterifikasi Fischer lebih disukai ketimbang asilasi dengan anhidrarida asam atau asil klorida. Kelemahan utama asilasi langsung adalah konstanta kesetimbangan kimia yang rendah. Hal ini harus diatasi dengan menambahkan banyak asam karboksilat, dan pemisahan air yang menjadi hasil reaksi.
Pemisahan air dilakukan melalui distilasi Dean -Stark atau penggunaan saringan molekul. Untuk mendapatkan ester yang tinggi dari reaksi kesetimbangan tersebut, reaksi harus diusahakan bergeser ke kanan dengan cara memberikan asam karboksilat atau alkohol berlebih, atau memisahkan antara ester yang terjadi dari hasil sampan reaksi. Penambahan dan pengurangan volume atau jumlah dan konsentrasi dapat mempengaruhi reaksi adalah sebagai berikut:
- Jika konsentrasinya dikurangi maka reaksi akan bergeser ke arah zat tersebut. Berarti jika konsentrasi etanol dikurangi maka produknya akan berkurang dan kestimbangan bergeser ke kiri.
- Jika konsentrasinya ditambah maka reaksi bergeser dari arah zat tersebut. Berarti jika konsentrasi asam asetat ditambah, maka produk akan bertambah karna bergeser ke kanan.
- Jika suhu dinaikkan maka reaksi akan bergeser ke arah kiri yaitu arah reaksi yang endoterm (+) dan produk akan berkurang. Jika suhu diturunkan (kalor dikurangi), maka reaksi akan bergeser ke arah kanan yaitu arah reaksi yang eksoterm (-).
C. Esterifikasi
Reaksi esterifikasi adalah suatu reaksi antara asam karboksilat dan alkohol membentuk ester. Esterifikasi dapat dikatalis oleh kehadiran ion H+. asam belerang sering digunakan sebagai suatu katalisator untuk reaksi ini. Nama ester berasal dari essig-ather jerman, sebuah nama kuno untuk menyebut etil asam cuka ester (asam cuka etil).
Ester dapat dibuat oleh suatu reaksi keseimbangan antara suatu alkohol dan suatu asam karbon. Ester dinamai menurut kelompok alkil dari alkohol dan kemudian alkanoat (bagian dari asam karbon). Sebagai contoh, reaksi antara metanol dan asam butir menghasilkan ester metil butir C3H7-COO-CH3 seperti halnya air. Yang paling sederhana adalah H-COO-CH3,metil metanoat. Karena ester dari asam yang lebih tinggi, alkana menyebut dengan – oat pada akhiran. Secara umum Ester dari asam berbau harum meliputi benzoat seperti metil benzoat. Reaksi esterifikasi merupakan reaksi pembentukan ester dengan reaksi langsung antara suatu asam karboksilat dengan suatu alkohol.
Seperti kebanyakan reaksi aldehida dan keton, esterifikasi suatu asam karboksilat berlangsung melalui serangkaian tahap protonasi dan detonasi. Oksigen karbonil diprotonasi, alkohol nukleofilik menyerang karbon positif dan eliminasi air akan menghasilkan ester
Esterifikasi mereaksikan minyak lemak dengan alkohol. Katalis-katalis yang cocok adalah zat berkarakter asam kuat.karena hal ini, asam sulfat, asam sulfonat organik atau resin penukar kation asam kuat merupakan katalis-katalis yang biasa terpilih dalam praktek industrial. Esterifikasi biasa dilakukan untuk membuat biodiesel dari minyak berkadar asam lemak bebas tinggi .
Faktor-faktor yang berpengaruh pada reaksi esterifikasi adalah waktu reaksi, pengadukan, katalisator,dan suhu reaksi. Proses esterifikasi dalam industri dapat dilakukan secara kontinyu maupun batch. Pemilihan kedua macam proses tersebut tergantung pada kapasitas produksinya. Untuk kapasitas produksi yang relatif kecil sebaiknya jenis yang digunakan adalah proses batch. Sedangkan proses esterifikasi kontinyu dipilih untuk kapasitas produksi yang relatif besar.
I. Proses Batch Produksi Etil Asetat
Proses produksi etil asetat secara batch pada prinsipnya adalah dengan memanaskan 30 bagian asam asetat 80%, 30 bagian etanol 95% dan 1 bagian asam sulfat dalam sebuah tangki silinder. Pemanasan dengan menggunakan steam yang dialirkan ke kolom fraksinasi. Suhu atas kolom fraksinasi dijaga 70oC agar dapat diperoleh komposisi ternary azeotrop, yaitu 83% etil asetat, 9% etanol dan 8% air. Uap hasil puncak dikondensasi, sebagian lagi direfluk, sebagian diambil sebagai produk.
II. Proses Kontinyu Produksi etil asetat
Proses produksi etil asetat secara kontiyu untuk memperoleh hasil yang maksimal. Asam asetat, etanol dan katalis asam sulfat direaksikan pada reaktor yang dilengkapi dengan pengaduk. Selanjutnya produk reaktor dipisahkan pada menara distilasi untuk memperoleh produk dengan kemurnian tinggi.
D. Cara-Cara Lain untuk Membuat Ester
1) Pembuatan Ester dari Alkohol dan Asil Klorida (Klorida Asam)
Jika kita menambahkan sebuah asil klorida kedalam sebuah alkohol , maka reaksi yang terjadi cukup proresif pada suhu kamar menghasilkan sebuah ester dan awan-awan dari asap hydrogen yang asam dan beruap.Sebagai contoh, jika kita menambahkan etanol klorida kedalam etanol,maka akan terbentuk bannyak hydrogen klorida bersama dengan ester cair etil etanoat.
CH3COCl + CH3CH2OH CH3COOCH2CH3 + HCl
2) Pembuatan Ester dari Alkohol dan Anhidrada Asam
Reaksi-reaksi dengan anhidrida asam berlangsung lebih lambat dibanding reaksi -reaksi yang serupa dengan asil klorida, dan biasanya campuran reaksi yang terbentuk perlu dipanaskan. Mari kita ambil contoh etanol yang bereaksi dengan anhidrida etanoat sebagai sebuah reaksi sederhana yang melibatkan sebuah alkohol. Reaksi berlangsung lambat pada suhu kamar(atau lebih capat dari pemanasan). Tidak ada perubahan yang bias diamati pada cairan yang berwarna, tetapi sebuah campuran etil etanoat dan asam etanoat terbentuk.
(H3CO)2O+CH3CH2OH CH3COOCH2CH3 + CH3COOH
Reaksi esterifikasi Fischer adalah reaksi pembuntukan ester dengan cara merefluks sebuah asam karboksilat bersama sebuah alkohol dengan katalis asam. Asam yang digunakan sebagai katalis biasanya biasanya adalah asam sulfat atau asam Lewis seperti skandium (III) triflat.
Pembentukan ester melalui asilasi langsung asam karboksilat terhadap alkohol , seperti pada esterifikasi Fischer lebih disukai ketimbang asilasi dengan anhidrarida asam atau asil klorida. Kelemahan utama asilasi langsung adalah konstanta kesetimbangan kimia yang rendah. Hal ini harus diatasi dengan menambahkan banyak asam karboksilat, dan pemisahan air yang menjadi hasil reaksi. Pemisahan air dilakukan melalui distilasi Dean -Stark atau penggunaan saringan molekul.
Mekanisme reaksi esterifikasi Fischer terdiri dari beberapa langkah.
1. Transfer proton dari katalis asam ke atom oksigen karbonol, sehingga meningkatkan elektrofilisitas dari aatom karbon karbonil
2. Atom karbon karbonil kemudian diserang atom oksigen dari alkohol, yang bersifat nukleofilik sehingga terbentuk ion oksonium.
3. Terjadi pelepasan proton dari gugus hidroksil milik alkohol, menghasilkan kompleks teraktivasi.
4. Protonasi terhadap salah satu gugus hidroksil, yang diikuti pelepasan molekul air menghasilkan ester.
2.3.2 Pembuatan Ester Berdasarkan Volatilitas.
Golongan proses dalam proses pembuatan ester berdasarkan volalitas.
· Golongan 1. Dengan ester yang sangat mudah menguap,seperti metil format,metil asetat,dan etil format,titik didih ester lebih rendah dari pada alkohol,oleh karena itu ester segera dapat dihilangkan dari campuran reaksi. Produksi metil asetat dengan metode destilasi bachaus merupaka sebuah contoh dari golongan ini.metanol dan asam asetat diumpankan kedalam kolom destilasi dan ester segera dipisahkan sebagai campuran uap dengan metanol dari bagian atas kolom.Air terakumulasi di dasar tangki dan selanjutnya dibuang.Ester dan alkohol dipisahkan lebih lanjut dalam kolom destilasi yang kedua.
· Golongan 2. Ester dengan kemampuan menguap sebaikmya dipisahkan dengan cara menghilangkan air yang terbentuk secara destilasi.Dalam beberapa hal, campuran terner dari alkohol.air dan ester dapat terbentuk.kelompok ini layak dipisahkan lebih lanjut: dengan etil asetat,semua bagian ester dipisahkan sebagai campuran uap dengan alkohol dan sebagian air,sedangkan sisa air akan terakumulasi dalam sistem.Dengan butil asetat,semua bagian air dipindahkan ke bagian atas dengan sedikit bagian dari ester dan alkohol, sedangkan sisa ester terakmulasi dalam sistem.
· Golongan 3. Dengan ester yang mempunyai volatilitas rendah,beberapa kemungkinan timbul.Dalam hal butil dan amil alkohol.Contoh proses untuk tipe seperti ini adalah pembuatan dibutil ftalat.Untuk menghasilkan ester dari alkohol yang lebih pendek (metil,etil,propil) dibutuhkan penambahan hidrokarbon seperti benzena dan toluena untuk memperbesar air yang terdestilasi.Dengan alkohol bertitik didih tinggi (benzil,furfil,b-feniletil) suatu cairan tambahan selalu diperlukan untuk menghilangkan kandungan air dari campuran.
2.4 Reaksi-Reaksi Ester (Hidrolisis Ester-Ester Sederhana)
2.4.1 Pengertian Hidrolisis
Secara teknis, hidrolisis adalah sebuah reaksi dengan air. Reaksi inilah yang sebenarnya terjadi ketika ester dihirolisis dengan air atau dengan asam encer seperti asam hidroklorat encer. Hidrolisis ester dengan basa melibatkan reaksi dengan ion-ion hidroksida, tetapi hasil keseluruhannya sangat mirip sehingga dikategorikan dalam hidrolisis dengan air atau asam encer.
2.4.2 Hidrolisis Menggunakan Air Atau Asam Encer
· Reaksi dengan air murni sangat lambat sehingga tidak pernah digunakan. Reaksi ini dikatalisis oleh asam encer, sehingga ester dipanaskan di bawah refluks dengan sebuah asam encer seperti asam hidroklorat encer atau asam sulfat encer.
· Berikut dua contoh sederhana dari hidrolisis menggunakan sebuah katalis asam:
1.Hidrolisis Etil Etanoat
CH3COOCH2CH3+H2O CH3COOH + CH3CH2OH
2. Hidrolisis Metil Propanoat
CH3CH2COOCH3+H2O CH3CH2COOH +CH3OH
Perhatikan bahwa kedua reaksi di atas dapat balik (reversibel). Untuk melangsungkan hidrolisis sesempurna mungkin, harus digunakan air yang berlebih. Air diperoleh dari asam encer, sehingga ester perlu dicampur dengan asam encer yang berlebih.
2.4.3 Hidrolisis menggunakan Basa Encer
· Ini merupakan cara yang lazim digunakan untuk menghidrolisis ester. Ester dipanaskan di bawah refluks dengan sebuah basa encer seperti larutan natrium hidroksida.
· Ada dua kelebihan utama dari cara ini dibanding dengan menggunakan asam encer. Reaksinya berlangsung satu arah dan tidak reversibel, dan produknya lebih mudah dipisahkan.
· Mari kita mengambil contoh ester sama seperti kedua contoh di atas, tapi menggunakan larutan natrium hdroksida bukan sebuah asam encer:
· Pertama, hidrolisis etil etanoat menggunakan larutan natrium hidroksida:
· CH3COOCH2CH3 + NaOH CH3COONa + CH3CH2OH
etil etanoat natrium etanoat etanol
dan selanjutnya hidrolisis metil propanoat dengan cara yang sama:
CH3CH2COOCH3+NaOH CH3CH2COONa+ CH3OH
metil propanoat natrium propanat metanol
Perhatikan bahwa terbentuk garam natrium bukan asam karboksilat sendiri. Campuran ini relatif mudah dipisahkan. Jika digunakan dan selanjutnya hidrolisis metil propanoat dengan larutan natrium hidroksida yang berlebih, tidak akan ada ester yang tersisa. Alkohol yang terbentuk bisa dipisahkan dengan distilasi. Pemisahan ini cukup mudah. Jika anda menginginkan terbentuk asam bukan garamnya, anda harus menambahkan asam kuat yang berlebih seperti asam hidroklorat encer atau asam sulfat encer ke dalam larutan yang tersisa setelah distilasi pertama.
Jika anda melakukan ini, campuran akan dibanjiri dengan ion-ion hidrogen. Ion-ion hidrogen ini ditangkap oleh ion-ion etanoat (atau ion paropanoat atau ion apapun) yang terdapat dalam garam membentuk asam etanoat (atau asam propanoat, dan lain-lain). Karena asam-asam ini adalah asam lemah, maka ketika bergabung dengan ion hidrogen, cenderung tetap bergabung. Sekarang asam karboksilat bisa dipisahkan dengan distilasi.
2.4.4 Hidrolisis ester-ester kompleks untuk membuat sabun
· Pembahasan ini berkaitan dengan hidrolisis basa (dengan menggunakan larutan natrium hidroksida) ester-ester besar yang ditemukan dalam lemak dan minyak hewani dan nabati.
· Jika ester-ester besar yang terdapat dalam lemak dan minyak hewani dan nabati dipanaskan dengan larutan natrium hdiroksida pekat, reaksi yang terjadi persis sama dengan reaksi pada ester-ester sederhana.
· Terbentuk asam karboksilat – kali ini, garam natrium dari sebuah asam besar seperti asam oktadekanoat (asam stearat). Garam-garam ini merupakan komponen sabun yang penting, yaitu komponen yang melakukan pembersihan.
· Juga terbentuk alkohol – kali ini, alkohol yang lebih rumit, propan-1,2,3-triol (gliserol). Karena hubungannya dengan pembuatan sabun, hidrolisis ester dengan basa terkadang disebut sebagai saponifikasi.
2.4.5 Reaksi ester dengan pereaksi Grinard
Ester bereaksi dengan dua ekuivalen pereaksi grinard menghasilkan alkohol tersier. Reaksi berlangsung melalui serangan nukleofil pada gugus karbonil ester. Hasil awalnya, keton, bereaksi lebih lanjut menghasilkan alcohol tersier.
Metode ini digunakan dalam pembuatan alcohol tersier damana paling sedikit dua dari 3 gugus alkil yang melekat pada atom karbon adalah identik.
2.4.6 Reduksi Ester
Ester dapat direduksi dengan litium hidrida menjadi alcohol
O
LiAlH4
R C OR’ RCH2OH + R‘OH
(ester) (alkohol primer)
2.5 Etil Asetat
Etil asetat merupakan salah satu jenis pelarut yang memiliki rumus molekul CH3COOC2H5. Produk turunan dari asam asetat ini memiliki banyak kegunaan serta pasar yang cukup luas seperti pengaroma buah dan pemberi rasa seperti untuk es krim, kue, kopi, teh atau juga untuk parfum,digunakan pada industri tinta cetak, cat dan tiner, lem, PVC film, polimer cair dalam industri kertas, serta banyak industri penyerap lainnya seperti industri farmasi, dan sebagainya.
Etil asetat disintesis melalui reaksi esterifikasi fischer dari asam asetat dan ethanol, biasanya disertai katalis asam seperti asam sulfat.
Reaksinya :
Etanol + Asam Asetat Etil Asetat + Air
C2H5OH + CH3COOH CH3COOC2H5 + H2O
Reaksi di atas merupakan reaksi reversibel dan menghasilkan suatu kesetimbangan kimia. Etil asetat dapat dihidrolisis pada keadaan asam atau basa menghasilkan asam asetat dan ethanol kembali. Katalis asam sulfat dapat menghambat hidrolisis karena berlangsungnya reaksi kebalikan hidrolisis yaitu esterifikasi fischer.
Etil asetat mempunyai ciri-ciri sebagai berikut :
- Tidak beracun dan tidak terhigrokopis.
- Merupakan pelarut polar menengah yang volatil (mudah menguap).
- Dapat melarutkan air hingga 3%, dan larut dalam air hingga kelarutan 8% pada suhu kamar.
- Merupakan penerima ikatan hidrogen yang lemah dan bukan suatu donor ikatan hidrogen karena tidak adanya proton yang bersifat asam (yaitu hidrogen yang terikat pada atom elektronegatif seperti flor, oksigen, dan nitrogen.
- Kelarutannya meningkat pada suhu yang lebih tinggi. Namun demikian, senyawa ini tidak stabil dalam air yang mengandung basa atau asam.
2.5.1 Pembuatan Etil Asetat
Pembuatan etil asetat dapat dilakukan dengan beberapa cara yaitu
- Esterifikasi fischer: merefluks asam dengan alkohol yang berlebihan dalam suasana asam.
- Mereaksikan garam perak karboksilat dengan alkil halide.
Reaksi asam dengan sintesis Williamson dari ester berlangsung melalui pertukaran atom unsur dua molekul yang meliputi pelepasan OAg dan reaksi itu pada wujudnya tidak dihalangi oleh adanya gugus alkil yang bercabang. Kelemahan cara ini adalah panjangnya prosedur dan mahalnya biaya. - Mereaksikan alkohol dengan anhidrida asam alkanoat.
- Mereaksikan halogen asam alkanoat dengan alkohol.
2.6 Transesterifikasi
Transesterifikasi (biasa disebut dengan alkoholisis) adalah tahap konversi dari trigliserida (minyak nabati) menjadi alkyl ester, melalui reaksi dengan alkohol, dan menghasilkan produk samping yaitu gliserol. Di antara alkohol-alkohol monohidrik yang menjadi kandidat sumber/pemasok gugus alkil, metanol
adalah yang paling umum digunakan, karena harganya murah dan reaktifitasnya paling tinggi (sehingga reaksidisebut metanolisis). Jadi, di sebagian besar dunia ini, biodiesel praktis identik dengan ester metil asam-asam lemak (Fatty Acids Metil Ester (FAME)). Reaksi transesterifikasi trigliserida menjadi metil ester
Transesterifikasi juga menggunakan katalis dalam reaksinya.Tanpa adanya katalis,konversi yang dihasilkan maksimum namun reaksi berjalan dengan lambat.Katalis yang biasa digunakan pada reaksi transesterifikasi adalah katalis basa, karena katalis ini dapat mempercepat reaksi. Produk yang diinginkan dari reaksi transesterifikasi adalah ester metil asam-asam lemak.Terdapat beberapa cara agar kesetimbangan lebih ke arah produk, yaitu:
- Menambahkan metanol berlebih ke dalam reaksi
- Memisahkan gliserol
- Menurunkan temperatur reaksi (transesterifikasi merupakan reaksi eksoterm).
2.6.1 Hal-hal yang Mempengaruhi Reaksi Transesterifikasi
Pada intinya, tahapan reaksi transesterifikasi pembuatan biodiesel selalu menginginkan agar didapatkan produk biodiesel dengan jumlah yang maksimum. Beberapa kondisi reaksi yang mempengaruhi konversi serta perolehan biodiesel melalui transesterifikasi adalah sebagai berikut:
a. Pengaruh air dan asam lemak bebas
Minyak nabati yang akan ditransesterifikasi harus memiliki angka asam yang lebih kecil dari 1. Banyak peneliti yang menyarankan agar kandungan asam lemak bebas lebih kecil dari 0.5% (<0.5%). Selain itu, semua bahan yang akan digunakan harus bebas dari air. Karena air akan bereaksi dengan katalis,sehingga jumlah katalis menjadi berkurang. Katalis harus terhindar dari kontak dengan udara agar tidak mengalami reaksi dengan uap air dan karbon dioksida.
b. Pengaruh perbandingan molar alkohol dengan bahan mentah
Secara stoikiometri, jumlah alkohol yang dibutuhkan untuk reaksi adalah 3 moluntuk setiap 1 mol trigliserida untuk memperoleh 3 mol alkil ester dan 1 mol gliserol. Perbandingan alkohol dengan minyak nabati 4,8:1 dapat menghasilkankonversi 98% (Bradshaw and Meuly, 1944). Secara umum ditunjukkan bahwa semakin banyak jumlah alkohol yang digunakan, maka konversi yang diperoleh juga akan semakin bertambah. Pada rasio molar 6:1, setelah 1 jam konversi yang dihasilkan adalah 98-99%, sedangkan pada 3:1 adalah 74-89%.Nilai perbandingan yang terbaik adalah 6:1 karena dapat memberikan konversiyang maksimum.
c. Pengaruh jenis alkohol
Pada rasio 6:1,metanol akan memberikan perolehan ester yang tertinggi dibandingkan dengaan menggunakan etanol atau butanol.
d. Pengaruh jenis katalis
Alkali katalis (katalis basa) akan mempercepat reaksi transesterifikasi bila dibandingkan dengan katalis asam.Katalis basa yang paling populer untuk reaksi transesterifikasi adalah natrium hidroksida(NaOH), kalium hidroksida(KOH), natrium metoksida (NaOCH3),dan kalium metoksida(KOCH3).
Katalis sejati bagi reaksi sebenarnya adalah ion metilat (metoksida). Reaksi transesterifikasi akan menghasilkan konversi yang maksimum dengan jumlah katalis 0,5-1,5%-b minyak nabati. Jumlah katalis yang efektif untuk reaksi adalah 0,5%-b minyak nabati untuk natrium metoksida dan 1%-b minyak nabati untuk natrium hidroksida.
Bab III. Metode Praktikum
A. alat dan bahan
- Labu didih dasar bulat
- Penangas air
- Kondensor Leibig
- Heating Mantel
- Erlenmeyer (50 ml)
- Gelas piala (100 ml)
- Corong pisah
- Gelas ukur (100 ml)
- Termometer
- Statip dan klem
- Lemari asam
- Corong
- Batang pengaduk
3.2 Bahan-Bahan
- Etanol (C2H5OH 96%)
- Asam sulfat pekat
- Asam asetat (CH3COOH pa)
- Na2CO3 20%
- CaCl2 anhidrat
3.3 Prosedur Percobaan
- Masukkan asam asetat 14 ml ke dalam labu didih dasar bulat.
- Tambahkan etanol sebanyak 29 ml.
- Tambahkan asam sulfat pekat 5 ml hati-hati, labu digoyang sempurna sambil didinginkan dalam air.
- Labu kemudian disambungkan dengan kondensor refluks selama 70 menit.
- Setelah dingin, campuran reaksi didestilasi sampai didapat destilat pada suhu 74-76o C. Proses destilasi dihentikan jika tidak ada lagi destilat yang menetes.
- Hasil detilat dimasukkan kedalam corong pemisah, pisahkan lapisan airnya jika ada.
- Cuci lapisan ester dengan larutan Na2CO3 20% sebanyak dua kali didalam corong pisah. Hasilnya akan terbentuk dua lapisan. Buang lapisan bawah, sedangkan lapisan atas merupakan etil asetat.
- Keringkan etil asetat yang didapat dengan CaCl2 Anhidrat secukupnya didalam gelas piala dan aduk dengan spatula. Setelah itu saring dengan kertas saring.
- Lakukan destilasi kembali terhadap ester hasil, kumpulkan destilat pada suhu 74-76o C (untuk mendapatkan hasil yang lebih murni).
Bab IV. Hasil dan pembahasan
A. Hasil
- volume etanol yang dipakai = 29 ml
- volume asam asetat yang dipakai = 14 ml
- volume asam sulfat yang dipakai = 5 ml
- suhu destilat yang didapat pada tetesan pertama = 54oC
- 20 menit setelah tetesan ke-I = 67oC
- 20 menit setelah tetesan ke-II = 68oC
- 20 menit setelah tetesan ke-III = 66oC
- 20 menit setelah tetesan ke-IV = 64oC
- Volume etil asetat yang didapat dari proses destilasi = 21 ml
- Volume Na2CO3 yang terpakai pada saat pencucian = 1,5 ml
- Berat CaCl2 yang terpakai untuk pengeringan = secukupnya
- Volume etil asetat yang didapat setelah proses pencucian dan pengeringan = 17 ml
- Rendemen etil asetat yang didapat = 68,8 %
B. Pembahasan
Senyawa etil asetat yang dibuat dalam percobaan ini adalah ester dari etanol dan asam asetat, dengan wujud berupa cairan tak berwarna dan memiliki aroma khas (balon). Esterifikasi pada dasarnya adalah reaksi yang bersifat reversibel (dapat balik) karena ketika asam karboksilat (asam asetat) dan alkohol (etanol) dipanaskan untuk bereaksi maka akan terjadi reaksi kesetimbangan antara ester dan air, artinya bahwa ester dan air yang terbentuk dapat kembali menghasilkan reaktan-reaktannya yaitu asam asetat dan etanol. Oleh karena itu, untuk memperoleh hasil reaksi yang banyak maka diusahakan agar reaksi cenderung bergeser ke arah produk yaitu dengan cara reaktan dibuat berlebih yang dalam percobaan ini etanol dibuat berlebih ketika direaksikan dengan asam asetat.
Pada pembuatan etil asetat hal pertama yang dilakukan adalah memasukkan etanol 29 ml dan asam asetat sebanyak 14 ml ke dalam labu didih dasar bulat, yang ditambah dengan beberapa batu didih. Fungsi batu didih adalah untuk menghomogenkan campuran, selain itu juga sebagai pemerata pemanasan. Kemudian ditambah dengan asam sulfat pekat sebanyak 5 ml sebagai katalis yang berguna untuk mempercepat reaksi dan menurunkan energi aktivasi yang dilakukan dalam lemari asam. Labu didih yang berisi larutan tersebut didinginkan dengan air yang terdapat pada panangas air dan digoyang sempurna. Hal ini dimaksudkan agar labu didih tidak pecah, karena terjadi reaksi eksoterm. Setelah itu larutan tersebut dipanaskan dengan kondensor refluks terbalik selama 70 menit dengan rentang suhu 74-76℃. Maksud dari refluks terbalik ialah larutan yang menguap dari labu didih akan masuk ke kondensor, dan akan kembali lagi ke labu didih.
Pada saat refluks suhu harus dijaga konstan pada rentang 74-76 oC. Jika suhu terlalu rendah maka reaksi tidak akan sempurna dan jika suhu terlalu tinggi, maka etanol akan menguap, karena titik didih etanol adalah 78℃. Setelah 70 menit, kemudian larutan didinginkan. Kemudian larutan didestilasi sampai didapat destilat pada suhu 74-76oC. Proses destilasi ini bertujuan memisahkan etil etanoat (etil asetat) dengan air,katalis,sisa asam dan sisa etanol atau dengan kata lain untuk mendapatkan etil asetat murni. Karena produk lain dari reaksi esterifikasi adalah H2O yang dapat dipisahkan dengan destilat karena antara air dan etil asetat memiliki perbedaan titik didih (air : 1000C sedangkan etil asetat : 770C). Sehingga destilat (memiliki titik didih rendah akan keluar terlebih dahulu) adalah etil etanoat (etil asetat). Volume etil asetat setelah proses destilasi sebanyak 21 ml.
Setelah itu, larutan etil asetat tersebut dicuci dengan Na2CO3 20% pada corong pemisah. Penambahan ini dimaksudkan untuk mengekstraksi asam sisa dalam larutan etil asetat karena Na2CO3 memiliki kemampuan untuk mengekstrak asam sisa menghasilkan garam natrium yang larut dalam air. Dari hasil percobaan terlihat bahwa garam natrium yang larut dalam air ini berada pada lapisan bawah sedangkan senyawa-senyawa organik berada pada lapisan atas. Pembentukan 2 lapisan ini disebabkan oleh adanya perbedaan berat jenis, dimana garam natrium yang larut dalam air memiliki berat jenis yang lebih besar daripada senyawa organik yang terbentuk ( berat jenis Na2CO3 : 2,25 gr/cm3, sedangkan berat jenis etil asetat : 0,89 gr/cm3). Selain itu, kepolaran juga sangat mempengaruhi terjadinya pemisahan lapisan ini, dimana garam natrium dalam air ini bersifat polar sedangkan senyawa-senyawa organik yang dihasilkan (etil asetat dan dietil eter) bersifat non polar.
Berdasarkan sifat kelarutannya, senyawa polar tidak akan larut dalam pelarut non polar dan begitu pula sebaliknya, pelarut polar tidak dapat melarutkan senyawa non polar. Lapisan bawah yang terbentuk dibuang sehingga hanya menyisahkan lapisan atas (etil asetat). Kemudian larutan etil asetat ditambahkan 3 sendok CaCl2 anhidrat yang sebelumnya dipanaskan dalam oven selama 5 menit pada suhu 100oC supaya dalam CaCl2 tidak ada lagi kandungan air. Hal ini dimaksudkan agar kadar air yang masih terdapat pada etil asetat tadi dapat diikat oleh CaCl2 anhidrat, dan terjadi proses pengeringan oleh CaCl2. Akan terbentuk 2 lapisan kembali dan lapisan bawah dibuang sehingga hanya menyisahkan lapisan atas yang berupa etil asetat murni.
Volume etil asetat yang diperoleh adalah 17 ml, dimana volume yang diperoleh lebih kecil dibandingkan volume awal. Hal ini disebabkan oleh beberapa faktor yaitu :
- Kemungkinan pada saat proses destilasi, ester masih tersisa pada labu didih yang tercampur pada asam asam.
- Reaksi esterifikasi merupakan reaksi reversibel dan berjalan lambat.
Sehingga rendemen yang diperoleh dari percobaan ini adalah 68,8%. Sebenarnya hal ini sudah bagus, hanya saja bila ingin mendapatkan hasil yang lebih maksimum hal tersebut dapat dicapai yaitu dengan cara ekses reaktan yang besar, pemasangan alat destilasi harus rapat contohnya kondensor (tidak terdapat celah untuk etil asetat menguap, karena etil asetat mudah menguap), juga kondisi optimum untuk menghasilkan etil asetat yaitu pada suasana asam (penambahan H2SO4 sebagai katalis perlu diperbanyak juga, karena dapat mempercepat pembentukan reaksi), serta suhu operasi harus pada suhu optimum dan dijaga konstan.
Bab V. Penutup
A. Kesimpulan
Dari hasil percobaan dapat disimpulkan bahwa :
- Volume etil asetat murni yang diperoleh dari percobaan adalah 17 ml.
- Rendemen yang diperoleh dari hasil percobaan adalah 68,8 %.
B. Saran
- Pada pembuatan ester kita harus menjaga suhunya agar konstan berkisar antara 74-76o C, karena apabila suhu terlalu tinggi dan terlalu rendah, maka ester yang ingin kita buat hasilnya hanya sedikit
- Dalam pemasangan alat harus dilakukan dengan benar karena pada saat destilasi apabila pemasangan kondensor tidak rapat, maka etil asetat akan menguap sehingga hasil yang didapat akan sedikit.
Daftar pustaka
Fessenden, Ralph J, dan Fessenden, Joan S. 1997. Dasar-dasatr Kimia Organik. Jakarta: Bina Aksara.
Keenan, Charles W, Kleinfelter, Donald C, dan Wood, Jesse H. 1992. Ilmu Kimia untuk Universitas.Jilid 2. Jakarta :Erlangga.
Riawan, S. 1990. Kimia Organik Edisi 1. Jakarta :Binarupa Aksara..
Tim kimia organic.2014.penuntun praktikum kimia organic.jambi:universitas jambi
Wilbraham, Antony C. 1992. Pengantar Kimia Organik 1. Bandung:ITB.
Leave a Reply
You must be logged in to post a comment.